
(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |

(17分)
(1)CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.1kJ/mol(3分,状态或配平或单位或+每少(或错)一项扣1分,最多扣3分;△H数值错了0分。)
(2)①正 (2分),②升高温度或增大H2O的浓度或减小CO的浓度 (2分)
(3)①>;(2分) ②>。(2分)
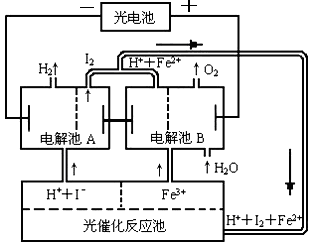
(4)O2+4e—+2H2O=4OH—(2分,没配平扣1分。)
c(K+)>c (HCO3- )>c (CO32- )>c (OH- )>c( H+ ) (4分)
解析试题分析:(1)已知:①H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ?mol-1
②CO(g)+1/2O2(g)=CO2(g) )△H=-283.0kJ?mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ?mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ?mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g),△H=(-44.0kJ?mol-1)+(-890.3kJ?mol-1)-(-283.0kJ?mol-1)-3×(-285.8kJ?mol-1)="+206.1" kJ?mol-1;
(2)①3—4min之间,甲烷的物质的量浓度减少,氢气的物质的量浓度增加,所以化学平衡向正反应方向移动;
②3min时,甲烷、氢气的浓度未变,说明与容器体积无关,而平衡正向移动,所以改变的条件是升高温度或增大H2O的浓度或减小CO的浓度 ;
(3)①根据增大一种反应物的浓度会增大另一种反应物的转化率,本身转化率降低,X1时甲烷的含量高,说明增大了甲烷的浓度,所以X1>X2;
②p1时的甲烷的含量高于p2,压强大对逆反应有利,所以p1>p2
(4)①放电时,正极是氧气发生还原反应,结合电解质溶液,正极反应式为O2+4e—+2H2O=4OH—
②标准状况下氧气的体积为8.96L,物质的量是0.4mol,则转移电子1.6mol,根据CH4~8e-~CO2,可知生成二氧化碳0.2mol,溶液中KOH的物质的量是0.3mol,n(CO2):n(KOH)=2:3,介于1/2-1之间,所以产物既有碳酸钾,又有碳酸氢钾,根据C元素与Na元素守恒,计算K2CO3、KHCO3的物质的量均是0.1mol,溶液中CO32-的水解程度大于HCO3-的水解程度,溶液呈碱性,所以溶液中离子浓度的大小关系是 c(K+)>c (HCO3- )>c (CO32- )>c (OH- )>c( H+ )。
考点:考查盖斯定律得应用,化学平衡的移动,电化学理论的应用,溶液中离子浓度的比较


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:填空题
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)如右图所示,常温下电解5 min后,铜电极质量增加2.16g。
试回答: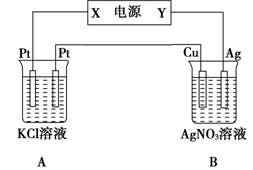
(1)电源电极X名称为_______(填“正极”或“负极”)。
(2)电解池B中阴极的电极反应式是__________。
(3)若A中KCl溶液的体积是200mL,电解后溶液的
pH=_________(忽略电解前后溶液体积的变化)。
若要使电解后的溶液恢复到与电解完完全相同,应加入的物质是__________。
(4)已知在l0lkPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,则CH4完全燃烧的热化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)汽车尾气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOX、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H1 ①
2C(s)+O2(g)=2CO(g) △H2 ②
C(s)+O2(g)=CO2(g) △H3 ③
写出NO与CO催化转化成N2和CO2的热化学方程式(反应热用△H1、△H2、△H3表示): 。
(2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOX的转化率,绘得图像如下图所示: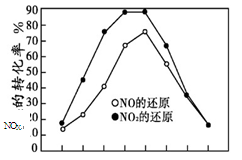
① 从图中可以得出的结论是
结论一:相同温度下, 。
结论二: 。
② 上述NO2和C3H6反应达平衡后,可提高NO2
转化率的措施有 。(填编号)
| A.加入催化剂 | B.降低温度 |
| C.分离出H2O(g) | D.增大压强 |
 O2+Hb·CO K=220
O2+Hb·CO K=220查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H=" -1275.6" kJ·mol-1
② H2O(l) H2O(g) △H=" +" 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
| 方法一 | CO(g) +2H2(g) 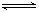 CH3OH(g) CH3OH(g) |
| 方法二 | CO2(g) +3H2(g) 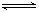 CH3OH(g) +H2O(g) CH3OH(g) +H2O(g) |
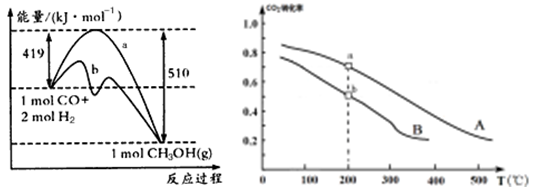
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(3分)氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O激光TiO22H2↑+O2↑。制得的氢气可用于燃料电池。则太阳光分解海水时,实现了从太阳能转化为_______能,水分解时,断裂的化学键有________,断裂该键 能量。(填“吸收”或“放出”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | | 6 | 8 |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 | 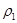 |  | |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
 d.混合气体的密度保持不变
d.混合气体的密度保持不变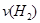 =
=  b.氮气的转化率:
b.氮气的转化率: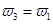 c.
c. 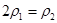 d.
d.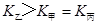
 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。下表为一些化学键的键能数据
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ·mol-1 | a | b | c |
 2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。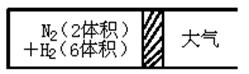
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)合成氨反应的热化学方程式:N2(g)+3H2(g) 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中要投放N2的物质的量为________ mol。
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式:__________________________,
负极的电极反应式:__________________________。
(3)如图是一个电解过程示意图。
①锌片上发生的电极反应式是:_______________________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com