
| A. | 相同物质的量的Al和A1(OH)3分别与等浓度的NaOH溶液反应,至体系中均无固体时,Al(OH)3消耗的碱量较多 | |
| B. | 反应N2O4+N2H4→N2+H2O中,若有1molN2O4参加反应,则有4mol电子发生转移 | |
| C. | 由Na2CO3和NaHCO3组成的混合物中,若n(Na+):n(C)=7:5,则n(Na2CO3):n(NaHCO3)=2:3 | |
| D. | 相同物质的量的浓硫酸分别与足量的铜和氧化铜反应,生成硫酸铜的两相同 |
分析 A.令Al和A1(OH)3的物质的量都为1mol,铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O根据方程式计算当体系中无固体物质时消耗碱的物质的量;
B.该反应中N元素化合价由-2价、+4价变为0价,所以N2H4被氧化,N2O4被还原,N2既是氧化产物又是还原产物,根据得失电子守恒、原子守恒配平方程式,根据方程式计算;
C.根据碳原子、钠原子守恒结合n(Na+):n(C)=7:5计算n(Na2CO3):n(NaHCO3);
D.浓硫酸与铜发生氧化还原反应,部分硫酸还原成二氧化硫,铜和稀硫酸不反应.
解答 解:A.令Al和A1(OH)3的物质的量都为1mol,铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知1molAl消耗NaOH的物质的量为1mol,氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O,由方程式可知1molAl(OH)3消耗NaOH的物质的量为1mol,两者消耗的碱量一样多,故A错误;
B.反应N2O4+N2H4→N2+H2O中,N元素化合价由-2价(N2H4)变为0价(N2),失去4e-,+4价(N2O4)变为0价(N2),得到8e-,最小公倍数为8,根据得失电子守恒、原子守恒,所以反应为2N2H4+N2O4═3N2↑+4H2O,若有1molN2O4参加反应,则有8mol电子发生转移,故B错误;
C.Na2CO3中2n(Na2CO3)=2n(C)=n(Na+),NaHCO3中n(NaHCO3)=n(C)=n(Na+),若n(Na+):n(C)=7:5,则,[2n(Na2CO3)+n(NaHCO3)]:[n(Na2CO3)+n(NaHCO3)]=7:5解得n(Na2CO3):n(NaHCO3)=2:3,故C正确;
D.根据Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,CuO+H2SO4=CuSO4+H2O可知,相同物质的量的H2SO4(浓)参加反应,前者生成的CuSO4的量比后者小,且与Cu反应时浓H2SO4变稀后不再反应,故D错误;
故选C.
点评 本题考查元素化合物有关知识,侧重考查铝、铜、钠、硫及其化合物的性质,为高频考点,掌握氢氧化铝的两性、氧化还原的配平技巧、原子守恒的应用是解答该题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
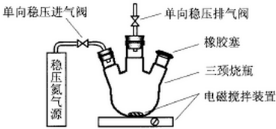 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 | |
| B. | 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应 | |
| C. | 在碘水中加入几滴淀粉溶液,溶液出现蓝色沉淀 | |
| D. | 碘水加入CCl4得到I2的CCl4溶液,该操作为萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,分子数为NA的CO、N2混合气体体积为22.4 L,其质量为28 g | |
| C. | 50 mL 8 mol•L-1的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA | |
| D. | 标准状况下,80 g SO3中含3NA个氧原子,体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中Fe3+的水解:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 邻羟基苯甲酸中加入足量NaHCO3溶液: +2HCO${\;}_{3}^{-}$→ +2HCO${\;}_{3}^{-}$→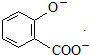 +2CO2↑+2H2O +2CO2↑+2H2O | |
| D. | 向含NaOH的Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | C5H11Cl有8种同分异构体 | |
| D. | 相同条件下,熔沸点:正丁烷<异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com