
分析 Ⅰ.①同周期自左而右电负性增大,金属性越强电负性越小,据此解答;
②由原子守恒可知,物质A为K2S,属于离子晶体;含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键;
Ⅱ.原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,再根据核外电子排布规律解答;
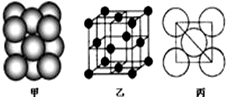
Ⅲ.由晶胞结构可知,以顶点原子为研究对象,与之最近的原子处于面心上,每个顶点原子为12个面共用,该晶胞构型为面心立方,据此判断;
Ⅳ.由中和生成的H+需要的NaOH溶液,可得出H+物质的量,进而计算出x,再结合Cr的化合价+3价,求n;利用离子交换反应计算出配离子的电荷数,再判断中心离子的配位数.
解答 解:Ⅰ.①同周期自左而右,电负性增大,金属性越强电负性越小,故电负性:O>N>C>K;
故答案为:O>N>C>K;
②由原子守恒可知,物质A为K2S,属于离子晶体,含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2,为sp杂化方式;
故答案为:离子晶体;sp;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1;
故答案为:1:1;
Ⅱ.原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe3+的核外电子排布式为1s24s22p63s23d5,3d能级有5个单电子;
故答案为:3d84s2;5.
Ⅲ.由晶胞结构图可知,以顶点原子为研究对象,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为面心立方最密堆积;
故答案为:12;面心立方最密堆积.
Ⅳ.中和生成的H+需浓度为0.1200mol•L-1NaOH溶液25.00mL,则可以得出H+的物质的量为0.1200mol•L-1×25.00×10-3L=0.0030mol,所以x=$\frac{0.0030}{0.0015}$=2,Cr的化合价为+3价,结合[CrCln(H20)6-n]x+,有3-n=2,可以得知n=1,即该配离子的化学式为[CrCl(H2O)5]2+;中心离子为氯离子,配体是Cr和H20,所以中心离子配位数是1+5=6,
故答案为:[CrCl(H2O)5]2+;6.
点评 本题考查比较综合,涉及电负性、杂化轨道、原子核外电子排布规律、晶胞的有关计算、配位数的确定、晶体中原子堆积方式等,注意对基础知识的理解掌握,整体把握元素周期表,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 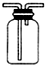 如图可用于收集气体H2、CO2、Cl2、NH3 | |
| B. | 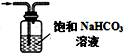 如图除去氯气中的氯化氢 | |
| C. | 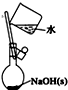 如图配制0.1mol/LNaOH溶液 | |
| D. |  如图苯萃取碘水中I2,分离出水后的操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
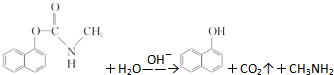
| A. | 西维因分子式为C12H10NO2 | |
| B. | 1 mol西维因最多能与6 mol氢气发生加成反应 | |
| C. | 反应后经酸化,可用FeCl3溶液检验是否发生水解 | |
| D. | 西维因分子中至少有21个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
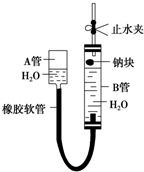 如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空:
如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
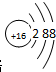 .
.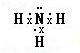 .
.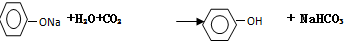 .
.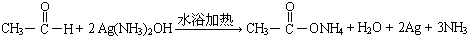 .
.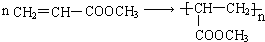 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60与金刚石互为同素异形体 | |
| B. | 114号元素的同位素其中子数为184,则该原子的质量数为298 | |
| C. | 酒精可以和钠发生置换反应,所以酒精属于电解质 | |
| D. | 分子式C2H5Cl只表示一种物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com