
下列叙述中,正确的是
A. 14C中含有14个中子
B. 1H、2H、3H是同一种核素
C. H2O与D2O(重水)互称同位素
D. C60、C70、金刚石、石墨均为碳的同素异形体
科目:高中化学 来源:2016-2017年新疆兵团第二师华山中学高二上学前考化学卷(解析版) 题型:选择题
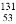 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中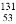 I的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
I的含量变化来监测核电站是否发生放射性物质泄漏。下列有关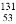 I的叙述中错误的是
I的叙述中错误的是
A. 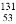 I的化学性质与
I的化学性质与 I相同 B.
I相同 B. 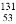 I的原子序数为53
I的原子序数为53
C. 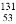 I的原子核外电子数为78 D.
I的原子核外电子数为78 D. 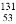 I的原子核内中子数多于质子数
I的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上开学考化学卷(解析版) 题型:实验题
某同学对“菠菜中富含可溶性草酸盐和碳酸盐,与豆腐同食会引起结石”的说法产生了兴趣。
探究一 菠菜里是否含有可溶性草酸盐和碳酸盐?
【查阅资料】
①可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙。
②醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。
【实验流程】
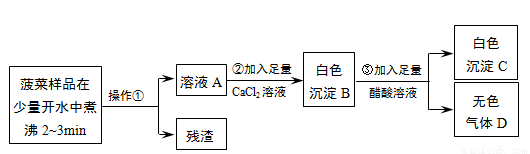
根据流程回答问题:(1)操作①是_________。 ( 2)加入足量CaCl2溶液的目的是_________。
(3)已知气体D能使澄清石灰水变浑浊,步骤③的化学反应方程式为_________。
【实验结论】菠菜里含有可溶性草酸盐和碳酸盐。
探究二 人体结石的主要成分是草酸钙,草酸钙高温分解的产物是什么?
【查阅资料】
① 草酸钙高温完全分解得到两种气态氧化物和一种固态氧化物。
② 12.8 g的草酸钙分解过程中温度与剩余固体的质量关系如下图所示。
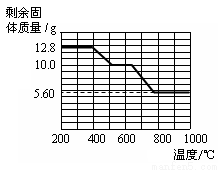
【实验分析】(4)草酸钙高温完全分解的化学方程式为_____________。
(5)通过上图数据分析,700℃时剩余固体的成分是_____________。
(6)请你设计实验,验证700℃时剩余固体的成分。
实验操作 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:选择题
在含有Fe3+、Fe2+、Al3+、NH4+的溶液中,加入足量的Na2O2固体,微热充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是
A.Fe3+ B.Al3+ C.Fe2+ D.NH4+
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列根据实验操作和实验现象所得出的结论,正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向两份蛋白质溶液中分别滴加饱和Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡后静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
C | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2样品已氧化变质 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:推断题
现有七种短周期主族元素,其原子序数按A、B、C、D、E、F、G的顺序递增。A元素的最高正化合价和最低负化合价的代数和等于0,且A是形成化合物种类最多的元素;C原子能形成分别含10电子、18电子的两种阴离子,且C与F位于同一主族;D单质投入冷水中反应缓慢,投入沸水中迅速产生气泡;E的简单阳离子是同周期元素所形成的简单离子中半径最小的。回答下列问题:
(1)B位于周期表第 周期第 族。
(2)元素M位于E与F元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池。M、F、G的气态氢化物的稳定性由强到弱的顺序为 (用化学式表示)。
(3)若选择三种试剂设计实验能证明非金属性:B>A>M,用化学方程式表示实验原理: 。
(4)下列实验方法能证明D与E的金属性强弱关系的是 。
A.比较D和E的单质分别与稀硫酸反应产生气泡的快慢
B.比较D和E的单质分别与同浓度的氢氧化钠溶液反应产生气泡的快慢
C.比较D和E的单质分别与氯气、氧气、硫等非金属单质反应的产物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:选择题
铁粉与足量1mol/l盐酸反应,为了加快反应速率且不影响产生氢气的量可以加入
①2mol/L的硝酸溶液 ②少量CuSO4(s) ③少量铜粉 ④少量CH3COONa(s) ⑤对溶液加热 ⑥向反应液中通入HCl气体 ⑦加入过量铁粉⑧将铁粉改为铁片
A.②③④⑤⑥ B.③⑤⑥ C.①③⑤⑥⑦ D.③⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:选择题
在恒容条件下,能使NO2(g)+CO(g) CO2(g)+NO(g)正反应速率增大且活化分子数也增加的措施是
CO2(g)+NO(g)正反应速率增大且活化分子数也增加的措施是
A.增大NO2或CO的浓度 B.减小CO2或NO的浓度
C.通入Ne使气体的压强增大 D.升高反应的温度
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期周考(8.28)化学试卷(解析版) 题型:推断题
某强碱性溶液可能含有的离子是K+、NH4+、A13+、A1O2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
I.取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
II.另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_________,肯定不存在的离子是_________。
(2)己知一定量的原溶液中加入5mL0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl-?
(3)按照反应顺序逐步书写出II中发生反应的离子反应方程式
①__________________;②______________________;
③__________________;④______________________;
⑤___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com