
| A. | 试管中加入少量苯,加入溴水振荡后,溴水褪色,发生了加成反应 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 苯较难发生加成反应,所以通常要加入催化剂 | |
| D. | 苯不能发生取代反应 |
分析 A.苯与溴水不能发生加成反应,但苯能萃取溴水中的溴而使溴水褪色;
B.苯化学性质稳定,不能被酸性高锰酸钾溶液氧化;
C.苯较难发生加成反,通常要加入催化剂,如苯与氢气反应需要Ni作催化剂;
D.苯环上含有H,可以被其他原子或原子团取代.
解答 解:A.苯与溴水不能发生加成反应,苯时一种常用的有机溶剂,能萃取溴水中的溴而使溴水褪色,故A错误;
B.苯化学性质稳定,苯不能被KMnO4氧化,不能酸性高锰酸钾溶液褪色,故B错误;
C.苯较难发生加成反应,通常需要加催化剂加快反应速率,在镍催化下与H2加成得环已烷,故C正确;
D.苯能发生取代反应,如苯与液溴在Fe作催化剂、加热条件下生成溴苯和溴化氢,故D错误;
故选C.
点评 本题考查了苯的性质,难度不大,苯的化学性质如下:
常温下,苯的化学性质较稳定,不与酸、碱、氧化剂反应.
1、氧化反应
苯在空气中易燃烧,火焰明亮,并产生浓烈黑烟.
注意:苯不能被KMnO4氧化,不能酸性高锰酸钾溶液褪色.
?2、取代反应
(1)卤代反应:苯环上氢原子被卤素原子取代
(2)硝化反应:苯环上氢原子被硝基取代 (了解)
(3)磺化反应:苯分子中氢原子被磺酸基取代
3、加成反应
镍催化下与H2加成得环已烷
总结:苯环具有特殊的稳定性,易取代,难加成,难氧化.


科目:高中化学 来源: 题型:填空题
 如图所示,各步反应的最后产物D是一种饱和一元醇,其蒸气密度是相同状况下H2密度的23倍,试回答下列问题:
如图所示,各步反应的最后产物D是一种饱和一元醇,其蒸气密度是相同状况下H2密度的23倍,试回答下列问题: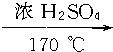 CH2═CH2↑+H2O,⑥CH3CH2Cl+H2O
CH2═CH2↑+H2O,⑥CH3CH2Cl+H2O CH3CH2OH+HCl,⑦CH3CHO+H2
CH3CH2OH+HCl,⑦CH3CHO+H2 CH3CH2OH,⑧2CH3CH2OH+O2
CH3CH2OH,⑧2CH3CH2OH+O2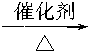 2CH3CHO+2H2O.
2CH3CHO+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
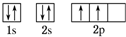 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
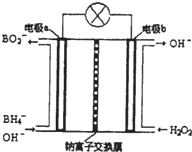 硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com