
【题目】NOx会引起光化学烟雾等环境问题,在催化剂存在条件下,以NH3或尿素将尾气中NOx
还原为N2的技术,即NH3或尿素-SCR技术,是去除NOx最为有效且应用最广的技术之一,其中最重要的催化剂体系是钒基催化剂。
(1)NH3去除尾气中的NOx,当v(NO):v(NO2)=l:1时称为“快速SCR 反应”,该反应化学方程式为___________。
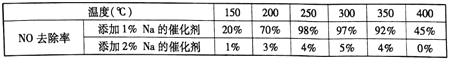
(2)不同钒含量的催化剂(V2O5/TiO2)添加WO3对NO去除率的影响如下图,从图中可以得出其它条件相同时添加WO3,对NO去除率的影响是_____(填“增大”、“减小”或“无影响”)。根据图中所示,随着温度升高NO去除率的变化趋势为_____,该变化趋势的一种可能原因是___________。

(3)在制备钒基催化剂时,添加的各种成型助剂中碱金属或碱土金属(如Na、K、Ca)能够使催化剂中毒(催化性能下降), K、Ca的毒化作用与Na相似。下列适合做成型助剂有_____。
A.Li B.Mg C.酸性铝溶胶 D.酸性硅溶胶
请设计实验研究添加金属K对催化剂活性的影响(只需写出实验思路,不需要具体实验
操作)_____________。
(4)在NOx催化去除过程中,NH3储罐存在危险性,更多应用为尿素-SCR技术。在该技术过程中,发生如下两个反应:
① CO(NH2)2=NH3+HNCO
② HNCO(g)+H20(g)====NH3(g)+CO2(g)
在此过程中一分子尿素可以生成两分子NH3,因此尿素被视为是NH3的有效储存源。反应②的平衡常数表达式为_______。目前商用的尿素溶液浓度为32.5%(密度为1.05g/mL),常称为“Ad Blue ”。1L该商用尿素溶液发生“快速SCR反应”, 理论上最多可消除NO和NO2在标准状况下的体积为______L。
【答案】(1) 2NH3+NO+NO2= 2N2+3H2O (2) 增大 减小 低温阶段,温度升高反应速率加快导致NO去除率增大;高温阶段,温度升高平衡逆向移动导致NO去除率下降;②低温阶段,温度升高反应速率加快导致NO去除率增大;高温阶段,发生NH3的非选择性氧化NOx反应。③低温阶段,温度升高反应速率加快导致NO去除率增大;高温阶段,催化剂活性下降。(其它合理答案均可) (3) C、D 分别向催化剂中添加1%K、2%K,并控制与(3)题中相同实验条件下,然后测定不同温度下的NO去除率,绘制成图表。 (4) [c(NH3)c(CO2)]/[c(HNCO)c(H2O)] 254.8
【解析】(1)当V(NO):V(NO2)=1:1时称为“快速SCR反应”,根据氧化还原方程式的原理可以书写配平得出:2NH3+NO+NO2= 2N2+3H2O;
(2)本小题要特别注意对图像的分析,根据控制变量的思想,当钒含量相同时可以发现,添加了WO3后,催化剂在各温度下对NO的去除率影响均为增大; 根据图像,其他因素相同时,低温阶段(350℃以下)温度升高NO去除率增大,高温阶段(350℃以上)随着温度升高NO去除率减小;可能的原因有:①低温阶段,温度升高反应速率加快导致NO去除率增大;高温阶段,温度升高平衡逆向移动导致NO去除率下降;②低温阶段,温度升高反应速率加快导致NO去除率增大;高温阶段,发生NH3的非选择性氧化NOx反应。③低温阶段,温度升高反应速率加快导致NO去除率增大;高温阶段,催化剂活性下降;
(3)在制备钒基催化剂时,添加的各种成型助剂中的碱金属或碱土金属(如Na、K、Ca)能够使催化剂中毒(催化性能下降),K、Ca的毒化作用与Na相似。A选项Li为碱金属,B选项Mg为碱土金属,故C、D中酸性铝溶胶和酸性硅溶胶更适合作为成型助剂; 根据表格中的实验情况,可以类似延伸,把握住控制变量的思想便可以设计出实验思路,另外要求绘制成图表,更加直观形象的展示出实验结果:分别向催化剂中添加1%K、2%K,并控制与(3)题中相同实验条件下,然后测定不同温度下的NO去除率,绘制成图表;
(4)根据平衡常数的定义可知:K=[c(NH3)c(CO2)]/[c(HNCO)c(H2O)]
理论上一分子尿素可以生成两分子NH3,所以此处不考虑反应②的可逆性,按照完全反应来进行理论计算,同时发生的是“快速SCR反应”,2NH3+NO+NO2= 2N2+3H2O,1mol CO(NH2)2~2mol NH3~1molNO+1mol NO2,V(NO+NO2)=![]() ×22.4L=254.8L。
×22.4L=254.8L。


科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成的二氧化碳和水的物质的量之比为1 :1,由此可得出的正确结论是( )
A. 该有机物分子中碳、氢、氧原子个数比为1 :2 :3
B. 该有机物分子中碳、氢原子个数比为1 :1
C. 该有机物中肯定含氧
D. 无法判断该有机物中是否含氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3的名称为硫代硫酸钠,可视为一个S原子取代了Na2SO4中的一个O原子。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究了自己的预测。
【提出假设】
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH____7(填“>”、“=”或“<”)。
(2)部分学生从S元素化合价推测Na2S2O3与Na2SO4性质相似,均具有较强的____。
【实验探究】取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)。
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
探究① | (3)____ | 溶液pH=8 | (4)____ |
探究② | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (5)____ |
【实验结论】
(6)探究①__________。
(7)探究②__________。
【问题讨论】
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于以下反应:A(s)+3B(g) ![]() 2C(g)+D(g),在一定温度、压强下,在体积可变的某容器中,当下列物理量不再发生变化时就可确定一定达到平衡状态的是
2C(g)+D(g),在一定温度、压强下,在体积可变的某容器中,当下列物理量不再发生变化时就可确定一定达到平衡状态的是
A. 混合气体的密度不随时间变化而变化 B. 3v正(B)=v逆(D)
C. 混合气体的压强保持不变 D. B、C、D的分子数之比为3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存且溶液为无色透明的一组离子的是
A.Cu2+、Na+、CO32-、SO42-
B.K+、Cl-、Na+、SO42-
C.Na+、NO3-、HCO3-、K+
D.Fe2+、MnO4-、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用DNA制造出一种臂长只有7nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中分散质的微粒直径与纳米粒子不具有相同数量级的是
A. 肥皂水 B. 蛋白质溶液 C. 硫酸铜溶液 D. 淀粉溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶的叙述,正确的是
A. 酶的基本组成单位酸或脱氧核苷酸 B. 酶为反应过程供能从而降低反应活化能
C. 酶在活细胞以外不具有催化活性 D. 酶可以是其他酶促反应的的底物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一定条件下将lmolA气体和3molB气体充入一个体积可变的密闭容器中,可滑动活塞的位置图1所示。在恒温恒压下发生A(g)+3B(g) ![]() 2C(g),当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率为( )
2C(g),当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率为( )
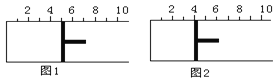
A. 20% B. 40% C. 50% D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com