
【题目】氢氧化铝和小苏打可作为治疗胃酸过多的内服药成分,两者
A. 受热均能分解 B. 都属于碱
C. 都属于两性氧化物 D. 都属于非电解质
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
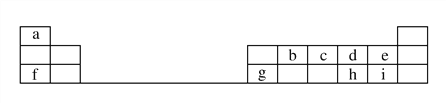
回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素a与c形成的4核10电子分子的化学式为________,其水溶液呈________性。
(3)元素e的负一价离子的结构示意图为________,元素g的简单离子的结构示意图为________,二者的离子半径大小顺序为________。
(4)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________,该化合物中所含的化学键类型为________________。
(6)元素d与h形成的化合物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过程中所要经历的反应及耗用氯气的量是(设乙烯为1mol,反应产物中的有机物只是四氯乙烷) ( )
A.取代反应 4 mol Cl2 B.加成反应 2 mol Cl2
C.加成反应、取代反应 2 mol Cl2 D.加成反应、取代反应 3 mol Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的B.按如图所示装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓硫酸反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按如图所示装置仪器,挤压滴管的胶头时,可以得到红色喷泉.
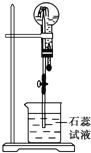
(1)A的化学式是 _______ 。
(2)可用于除去B中水分的干燥剂是 __________ ,收集气体B的方法是 ______________ 。
(3)收集气体C的方法是 ________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项决定于原子结构的哪一部分:①质子数,②中子数,③原子的最外层电子数.(以下各项选择序号填空)
(1)元素的种类取决于;
(2)原子的质量数主要由决定;
(3)元素的化学性质主要由决定.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
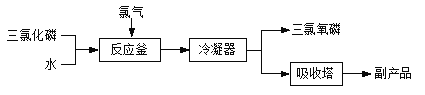
(1)氯化水解法生产三氯氧磷的化学方程式为___________________________。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用20 mL H3PO3溶液与同浓度的NaOH溶液40mL恰好完全反应,生成的盐为___________________(填“正盐”或“酸式盐”)。
②H3PO3中,P元素的化合价为_______________________。H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________________________。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是______________________________________。
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·Lˉ1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定选用的指示剂是__________(选填字母)。
a.FeCl2b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中若未加入硝基苯这项操作,所测Cl元素含量将会_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=__________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为____________________;
b.该温度下,反应I的平衡常数K=______________。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
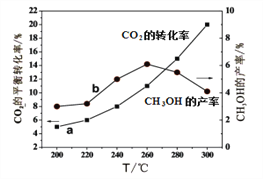
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com