
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.合金的熔点一般比组分金属低
B.铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出
D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
D
【解析】
试题分析:A选项,合金的熔点比组成它的各物质的成分都要低,所以A选项是正确的。对于选项B,铝钠合金投入水中得到无色溶液,意味着没有氢氧化铝沉淀,根据元素守恒,铝元素只能以偏铝酸根的形式存在,则溶液一定含有偏铝酸钠,可能含有氢氧化钠,故钠的物质的量要比铝多,故选项B正确。对于选项C,根据金属活动性顺序,【钾钙钠镁铝 锌铁锡铅氢 铜汞银铂金】,钠是先跟水(氢)反应,一定有氢氧化钠生成,故一定有氢氧化铜沉淀,故选项C正确。对于选项D,根据方程式可知,2*27克铝和足量酸反应,生成3mol氢气,也即18克铝生成1mol氢气 根据方程式可知,23克钠和足量酸反应,生成1mol氢气,可知钠铝合金中,铝越多,生成氢气越多,故D错误
考点:考查金属铝与氢氧化钠反应的相关知识点


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2013-2014浙江省杭州市高二年级教学质量检测模拟卷化学试卷(解析版) 题型:填空题
(5分)常温下,将三种一元酸(HX、HY、HZ)分别和NaOH溶液等体积混合,实验数据如下:
酸 | c(一元酸) /mol·L–1 | c(NaOH) /mol·L–1 | 混合溶液的pH |
HX | 0.1 | 0.1 | pH = x |
HY | 0.1 | 0.1 | pH = 7 |
HZ | 0.1 | 0.1 | pH = 9 |
(1)上述三种酸中一定属于强酸的是 ,
(2)HZ和NaOH发生反应的离子方程式为 ,所得溶液中pH大于7的原因是 (用化学方 程式表示)。
(3)HX反应后所得溶液中,由水电离产生的c(OH-)= mol·L-1,下列叙述是对x 值的判断,其 中正确的是 。
A.一定=7 B.可能<7 C. 一定≧7 D.一定>7
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 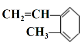 与Br2发生1:1加成反应的产物有5种
与Br2发生1:1加成反应的产物有5种
B.除去苯中 的方法:加溴水,充分振荡,静置分液。
的方法:加溴水,充分振荡,静置分液。
C. 1mol 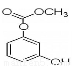 最多能与4mol氢氧化钠反应。
最多能与4mol氢氧化钠反应。
D.采用分子筛固体酸作为苯和丙烯反应的催化剂来制备异丙苯,符合绿色化学工艺。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:实验题
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。
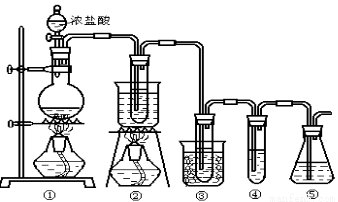
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
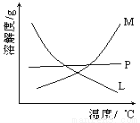
(2)比较制取氯酸钾和次氯酸钠的条件.二者的差异是 。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是: 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液最初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 |
______________________________________ |
然后溶液从无色逐渐变为 色 |
_________________________________________ |
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是
A.2.24g B.3.36g C.5.60g D.10.08g
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
两种微粒含有相同的质子数和电子数,这两种微粒可能是
①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子;④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子;⑦两种不同阳离子;⑧两种不同阴离子;⑨一种阴离子和一种阳离子
A.①③⑤⑥⑦⑧ B.①③⑤⑦⑧
C.①③④⑤⑦ D.全部都是
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高二下学期期末考试化学试卷(解析版) 题型:填空题
有机物A、B、C、D、E、F、G、H相互转化关系如下图所示。5.2 g F能与100 mL 1 mol/L NaOH溶液恰好完全中和,0.1 mol F还能与足量NaHCO3反应,在标准状况下放出4.48 L CO2。D的分子式为C3H3O2Na,E的分子中含有羧基。
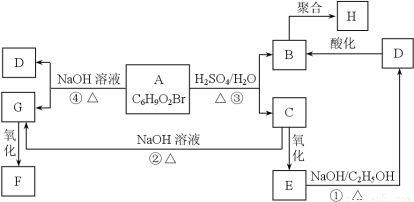
(1)写出物质C中的官能团的名称: ;
(2)写出物质F、H的结构简式;
F 、H ;
(3)写出反应①、④的化学反应类型:① 、④ ;
(4)写出变化①、③的化学方程式;
①
③
(5)写出相对分子质量比B大14,且与B具有相同官能团的所有物质的结构式(不考虑立体异构)。
。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高二下学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法一定正确的是 ( )
A.常温下,1 L 0.1 mol/L的NH4NO3溶液中氧原子数为0.3NA
B.1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
C.常温、常压下,4.6 g NO2和N2O4混合气体中含有的O原子数目为0.2NA
D.Fe与水蒸气在高温条件下反应,有1 mol Fe参与反应,则转移电子的数目为3NA
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷一试卷(解析版) 题型:填空题
(15分)氨是最重要的化工产品之一。
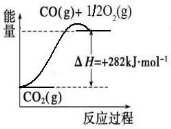
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)  CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。


(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO] (l)+CO(g)+NH3(g) [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为_________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。

(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3·H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com