
【题目】100 mLAl2(SO4)3溶液中,含有 Al3+为 1.62 g,在该溶液中加入 0.3 mol/L Ba(OH)2溶夜100 mL,反应后溶液中SO42-的物质的量浓度约为(混合体积看成两液体体积之和)
A. 0.4 mol/LB. 0.3mol/LC. 0.2mol/LD. 0.1 mol/L
【答案】B
【解析】
Al2(SO4)3溶液中Al3+的浓度c(Al 3+)=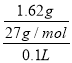 =0.6mol/L,根据硫酸铝的组成可知溶液中SO42-的浓度为c(SO42-)=
=0.6mol/L,根据硫酸铝的组成可知溶液中SO42-的浓度为c(SO42-)=![]() c(Al 3+)=
c(Al 3+)=![]() ×0.6mol/L=0.9mol/L,n(SO42-)=cV=0.9mol/L×0.1L=0.09mol,向该溶液中加入氢氧化钡,二者反应生成硫酸钡和水,n[Ba(OH)2]=0.1mol/L×0.3L=0.03mol,0.03molBa2+完全反应需要0.03mol SO42-,则混合溶液中剩余SO42-的物质的量为0.09mol-0.03mol=0.06mol,因此混合溶液中SO42-物质的量浓度c=
×0.6mol/L=0.9mol/L,n(SO42-)=cV=0.9mol/L×0.1L=0.09mol,向该溶液中加入氢氧化钡,二者反应生成硫酸钡和水,n[Ba(OH)2]=0.1mol/L×0.3L=0.03mol,0.03molBa2+完全反应需要0.03mol SO42-,则混合溶液中剩余SO42-的物质的量为0.09mol-0.03mol=0.06mol,因此混合溶液中SO42-物质的量浓度c=![]() =
=![]() =0.3mol/L,故合理选项是B。
=0.3mol/L,故合理选项是B。


科目:高中化学 来源: 题型:
【题目】能源与人类的生活和社会发展密切相关,下列有关说法不正确的是( )
A.用植物秸秆生产酒精代替汽油作汽车燃料
B.实行垃圾分类回收,将垃圾中的生物质能转化为热能
C.在农村提倡利用沼气作生活燃料
D.人类利用的能源都是通过化学反应获得的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4·2H2O![]() 3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
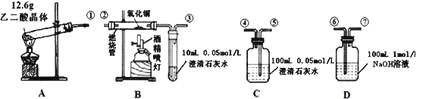
(1)检验装置A气密性的方法是
(2)按气流方向连接各仪器,用数字表示接口的连接顺序:
①→
(3)证明CO存在的实验现象是
(4)本实验尾气处理的方法是
(5)根据题给的数据,假设各反应均充分发生且产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋硝香豆素是一种洽疗心脑血管疾病的药物,能阻碍血栓扩展。醋硝香豆素可以通过以下方法合成(部分反应条件已省略)。
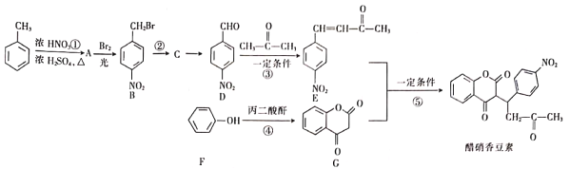
请回答下列问题:
(1)A的名称是___________;醋硝香豆素中所含官能团的名称为___________。
(2)反应①的反应类型是___________;反应⑤的反应类型为___________。
(3)C的结构简式为___________;反应④的化学方程式为______________________。
(4)关于E物质下列说法正确的是___________(填字母)
a.可以用酸性高锰酸钾溶液鉴别D和E
b.在核磁共振氢谱中有五组吸收峰
c存在顺反异构
d可以发生加成反应、聚合反应、氧化反应和消去反应
(5)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有___________种
①可与氯化铁溶液发生显色反应;②可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的结构简式为___________。区分上述G的各种同分异构体可选用的仪器是___________(填字母)
a.元素分析仪 b.红外光谱仪 c.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是
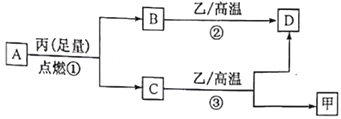
A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1 ,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A. -317.3kJ·mol-1 B. -379.3kJ·mol-1 C. -332.8kJ·mol-1 D. +317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )

A. 0-20 s内平均反应速率v(N2O5)="0.1" mol·L-1·s-1
B. 10 s时,正、逆反应速率相等,达到平衡
C. 20 s时,正反应速率大于逆反应速率
D. 曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com