
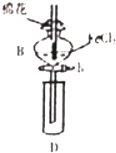
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程ⅠV中检出离子 | |
| 甲 | 有 Fe3+无 Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有S042- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
分析 Ⅰ.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,则氯气将二价铁氧化成三价铁时,停止通气;
Ⅱ.打开活塞b,使约2ml的溶液流入D试管中,用KSCN溶液来检验溶液中的三价铁离子;
Ⅲ.接着再向B中通入一定量的SO2气体,还原三价铁,生成二价铁和硫酸根;
Ⅳ.更新试管D,重复过程Ⅱ,用先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,来检验有SO42-;据此分析解答;
(1)仪器B的名称是分液漏斗;Cl2、SO2有毒污染空气,应有尾气处理,装置中的棉花需要浸润强碱溶液吸收Cl2、SO2;
(2)实验室用二氧化锰与浓盐酸加热来制备氯气;反应中消耗4molHCl,会生成2mol氯气,转移了2mol电子;
(3)根据以上分析,过程Ⅲ中一定发生反应为二氧化硫还原三价铁,生成二价铁和硫酸根;用先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,来检验有SO42-;
(4)该题的理论依据是氧化还原反应中氧化剂的氧化性强于氧化产物,也强于还原剂的氧化性;
甲.B可能有存在溶解的氯气氧化SO2;
乙.B中存在Fe3+、Fe2+,说明Cl2氧化性强于Fe3+,且没有Cl2剩余;故后有SO42-能说明Fe3+氧化性强于SO2;
丙.B中存在Fe3+,说明Cl2氧化性强于Fe3+;后生成了Fe2+,只能是Fe3+被SO2还原;
根据乙和丙的分析判断SO2、Fe2+和Cl-还原性强弱顺序.
解答 解:Ⅰ.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,则氯气将二价铁氧化成三价铁时,停止通气;
Ⅱ.打开活塞b,使约2ml的溶液流入D试管中,用KSCN溶液来检验溶液中的三价铁离子;
Ⅲ.接着再向B中通入一定量的SO2气体,还原三价铁,生成二价铁和硫酸根;
Ⅳ.更新试管D,重复过程Ⅱ,用先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,来检验有SO42-;
(1)仪器B的名称是分液漏斗;Cl2、SO2有毒污染空气,应有尾气处理,装置中的棉花需要浸润强碱溶液吸收Cl2、SO2,
故答案为:分液漏斗; NaOH溶液;吸收Cl2、SO2,防尾气污染环境;
(2)实验室用二氧化锰与浓盐酸加热来制备氯气,方程式为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4molHCl会生成2mol氯气,转移了2mol电子,转移的电子数为2NA,
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;2NA;
(3)根据以上分析,过程Ⅲ中一定发生反应为二氧化硫还原三价铁,生成二价铁和硫酸根,方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;用先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,来检验有SO42-;
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无;
(4)根据通入Cl2,当B的溶液变黄,说明氯气将二价铁氧化成三价铁,则氧化性氯气大于三价铁离子,还原性Fe2+>Cl-;当通入一定量的SO2气体时,有硫酸根生成,说明二氧化硫将二价铁还原成三价铁,则还原性SO2>Fe2+;故答案为:SO2>Fe2+>Cl-;
(5)该题的理论依据是氧化还原反应中氧化剂的氧化性强于氧化产物,也强于还原剂的氧化性,
甲.B可能有存在溶解的氯气氧化SO2,故甲错误;
乙.B中存在Fe3+、Fe2+,说明Cl2氧化性强于Fe3+,且没有Cl2剩余;故后有SO42-能说明Fe3+氧化性强于SO2,故乙正确;
丙.B中存在Fe3+,说明Cl2氧化性强于Fe3+;后生成了Fe2+,只能是Fe3+被SO2还原,故丙正确;
根据乙和丙的分析可知,SO2、Fe2+和Cl-还原性强弱顺序是:SO2>Fe2+>Cl-,
故答案为:乙、丙;SO2>Fe2+>Cl-.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的及实验原理为解答关键,注意掌握判断氧化性、还原性强弱的方法,试题培养了学生的分析能力及化学实验能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的结构类似于金刚石 | |
| B. | 硅是良好的半导体材料 | |
| C. | 硅的性质较稳定,在自然界中存在游离态 | |
| D. | 可以用焦炭还原二氧化硅生成硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2→O2 | B. | FeCl2→FeCl3 | C. | KClO3→O2 | D. | Al2O3→AlO${\;}_{2}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ | |
| C. | 由C(石墨)=C(金刚石);△H=+1.90 kJ/mol可知,金刚石比石墨稳定 | |
| D. | 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三者对应的氧化物均为酸性氧化物 | |
| B. | 三者的单质直接与氧气反应都能生成两种及以上氧化物 | |
| C. | 三者对应氢化物的水溶液可能呈中性、碱性、酸性 | |
| D. | C02、N02、S02都能与H20反应,其反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质所含元素化合价升高的反应叫还原反应 | |
| B. | 能通过化合反应制得FeCl2和Fe(OH)3 | |
| C. | 某元素由化合态变为游离态,则它一定被还原 | |
| D. | 有单质参加的化学反应一定都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “氯碱法”的副产品为氢气 | B. | “铝热法”常用于冶炼铁 | ||
| C. | “空气吹出法”用于海水中提取碘 | D. | “侯氏制碱法”制得的是火碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com