
(16分)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式 。
已知: ① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
①该反应的△H 0(填“<”、“=”或“>”)。
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由________________________。
③某温度下,将0.1 mol CO和0.3 mol H2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
(1)CO2(g)+4H2(g)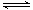 CH4(g)+2H2O(g) ΔH=-162kJ·mol-1 (3分,热化学方程式2分,数据1分)
CH4(g)+2H2O(g) ΔH=-162kJ·mol-1 (3分,热化学方程式2分,数据1分)
(2)①< (3分)
②相对于N点而言,采用M点,温度在500-600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高。 (3分)
③(7分)
CO(g)+3H2(g) 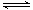 CH4(g)+H2O(g)
CH4(g)+H2O(g)
起始时各物质浓度/ mol·L-1: 0.01 0 .03 0 0
平衡时各物质浓度/ mol·L-1 0.002 0.006 0.008 0.008
(以上3分)
K=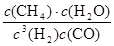 =
=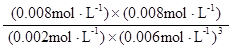 =0.148×106
=0.148×106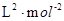
(1分) (1分) (2分,数据和单位各1分)
解析试题分析:
⑴先写出该反应的方程式,并标明各物质的状态:CO2(g)+4H2(g)=CH4(g)+2H2O(g);将“②+③-①×2”能得该反应方程式,再根据盖斯定律可计算该反应的反应热△H=(-73kJ?mol-1)+(-171kJ?mol-1)-(-41kJ?mol-1)×2=-162kJ?mol-1,综上便可写出完整的热化学方程式。
⑵①由图可知,压强一定时,升高温度,平衡时氢气的转化率降低,平衡向逆反应方向移动,正反应为放热反应,则△H<0;
②相对于N点而言,采用M点,温度在500-600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高;
③平衡时H2的转化率为80%,参加反应氢气的物质的量=0.3mol×80%=0.24mol,则氢气的浓度变化量=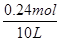 =0.024mol/L,然后结合三段分析如下:
=0.024mol/L,然后结合三段分析如下:
CO(g)+3H2(g)?CH4(g)+H2O(g)
开始(mol/L):0.01 0.03 0 0
变化(mol/L):0.008 0.024 0.008 0.008
平衡(mol/L):0.002 0.006 0.008 0.008
故平衡常数K=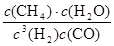 =
=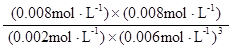 =0.148×106
=0.148×106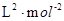 。
。
考点:考查盖斯定律、化学反应速率和化学平衡。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
下列反应中,生成物的总能量大于反应物的总能量的是
| A.氢气在氧气中燃烧 | B.焦炭在高温下与水蒸气反应 |
| C.铝与三氧化二铁高温反应 | D.铁丝在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(每空1分,共7分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。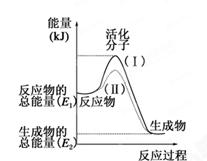
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将______转化为________。
(3)下列反应中,属于放热反应的是________,属于吸热反应的是________。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)工业上常用天然气作为制备甲醇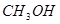 的原料。已知:
的原料。已知:
①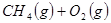
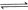
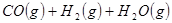
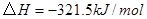
②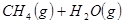
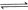
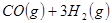
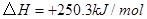
③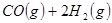
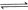
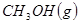
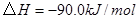
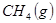 与
与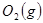 反应生成
反应生成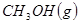 的热化学方程式为 。
的热化学方程式为 。
(2)向VL恒容密闭容器中充入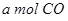 与
与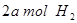 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: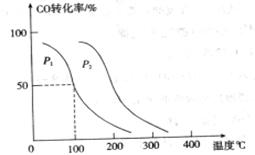
①压强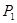
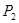 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在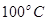 、
、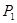 压强时,平衡常数为 (用含
压强时,平衡常数为 (用含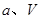 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s) 3CO2(g)+ 2Fe(s) △H<0
3CO2(g)+ 2Fe(s) △H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, 。
| A.容器中Fe2O3的质量不随时间而变化 | B.反应物不再转化为生成物 |
| C.n (CO) :n (CO2) = 1:1 | D.容器中气体的压强不随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4的燃烧热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:负极的电极反应式是 。
(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,充电时:阳极反应式: 用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
2PbSO4+2H2O,充电时:阳极反应式: 用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g) 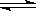 CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示,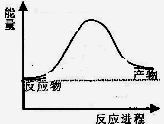
则该反应为 反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 | C—H | O—H | C=O | H—H |
| 吸收热量(kJ/mol) | a | b | c | d |
 CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知: C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) ΔH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com