
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 已知某温度下,Ksp(AgCl)=1×10-10,Ksp(Ag2CrO4)=1×10-12.若将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生Ag2CrO4沉淀 |
分析 A.二者恰好反应生成碳酸钠,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-);
B.反应后溶质为等浓度醋酸、醋酸钠和氯化钠,混合液呈酸性,说明醋酸的电离程度大小醋酸根离子的水解程度,则c(CH3COO-)>c(Cl-)>c(CH3COOH);
C.氨水为弱碱,混合液中氨水过量,溶液呈碱性,c(H+)<c(OH-),结合电荷守恒判断;
D.根据Ksp(AgCl)、Ksp(Ag2CrO4),计算当Cl-、CrO42-开始沉淀时的c(Ag+),计算出的银离子浓度越小,优先生成沉淀.
解答 解:A.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,反应后溶质为碳酸钠,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-),正确的离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故A错误;
B.20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后,溶质为等浓度的醋酸、醋酸钠和NaCl,溶液呈酸性,说明醋酸的电离程度大小醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),根据物料守恒c(CH3COO-)+c(CH3COOH)=2c(Cl-)可得:c(CH3COO-)>c(Cl-)>c(CH3COOH),溶液中离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B正确;
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,氨水为弱碱,混合液呈碱性,则c(H+)<c(OH-),根据电荷守恒可得:c(Cl-)<c(NH4+),则:c(Cl-)+c(H+)<c(NH4+)+c(OH-),故C错误;
D.当Cl-开始沉淀时c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.001}$=1.8×10-7mol/L,当CrO42-开始沉淀时,(Ag+)=$\sqrt{\frac{1×1{0}^{-12}}{0.001}}$=1×10-4.5 mol/L,则饱和AgCl溶液中c(Ag+)比饱和Ag2CrO4溶液中c(Ag+)小,故在同浓度的KCl和K2CrO4混合溶液中滴入AgNO3溶液,先生成AgCl沉淀,故D错误.故选B.
点评 本题考查了离子浓度大小比较、溶度积的计算等知识,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
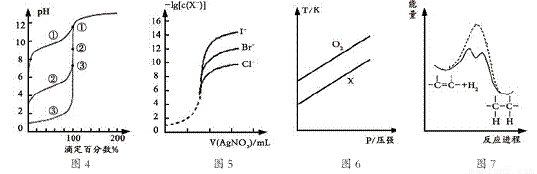
A. 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C. 在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D. 由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L酸性KMnO4溶液,滴入所得溶液 | 溶液紫红色褪去 | 含有Fe2+(或溶液紫红色不褪去,不含Fe2+) |
| 步骤②:另取少量所得溶液,滴加KI-淀粉溶液 | 含有Fe3+ | ||
| 验证猜想Ⅱ | 将所得气体通入如图装置: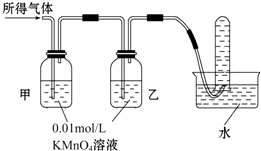 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L的稀盐酸1L | B. | 73g HCl | ||
| C. | 44.8 L HCl | D. | 1.204×1024个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| B. | NA个Fe(OH)3胶体粒子的质量为107g | |
| C. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| D. | 2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 项 | B. | 1 项 | C. | 2 项 | D. | 3 项 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:实验题
某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:
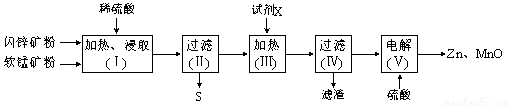
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 。
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: 。
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3。pH调节的范围是 ,试剂X可以选用 (填选项字母)。
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3·H2O
(4)电解(Ⅴ)中阳极的电极反应式为 。
(5)Zn和MnO2是制作电池的原料。某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。该电池的正极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com