
在恒温恒压下,向密闭容器中充入4mol
A和2 mol B,发生如下反应:2A(g)+B(g) 2C(g)
ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( )
2C(g)
ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( )
A.若反应开始时容器体积为2L,则Vc=0.4mol•L-1•min-1
B.若在恒压绝热条件下反应,平衡后nc<<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
B
【解析】
试题分析:由于该反应是体积减小的可逆反应,所以若反应开始时容器体积为2L,则平衡时容器的容积小于2L,所以Vc> =0.4mol•L-1•min-1,A不正确;由于反应是放热反应,所以如果在恒压绝热条件下反应,则温度升高,不利于平衡向正反应方向进行,则平衡后nc<1.6mol,选项B正确;若2min后,向容器中再投入等物质的量A、C,则相当于是再次通入物质的量之比大于2:1的A和B,所以B的转化率增大,C不正确;由于该反应是体积减小的可逆反应,所以若该反应在恒温恒容下进行,则不利于平衡向正反应方向进行,放出热量将减少,D不正确,答案选B。
=0.4mol•L-1•min-1,A不正确;由于反应是放热反应,所以如果在恒压绝热条件下反应,则温度升高,不利于平衡向正反应方向进行,则平衡后nc<1.6mol,选项B正确;若2min后,向容器中再投入等物质的量A、C,则相当于是再次通入物质的量之比大于2:1的A和B,所以B的转化率增大,C不正确;由于该反应是体积减小的可逆反应,所以若该反应在恒温恒容下进行,则不利于平衡向正反应方向进行,放出热量将减少,D不正确,答案选B。
考点:考查反应速率的计算、外界条件对反应速率的影响
点评:该题设计新颖,综合性强,对学生的思维能力要求高,学生不易得分。明确反应的特点,以及反应中的变量是答题的关键,有利于培养学生的逻辑推理能力和发散思维能力,有助于提升学生的学科素养。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应2A(g)+B(g)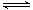 2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ( )
2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ( )
A.若反应开始时容器体积为2 L,则υC=0.4mol/L·min
B.若在恒压绝热条件下反应,平衡后nC<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
查看答案和解析>>
科目:高中化学 来源:辽宁模拟 题型:单选题
| A.x=3,y=1 | B.x=2,y=3 | C.x=4,y=1 | D.x=5,y=1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com