
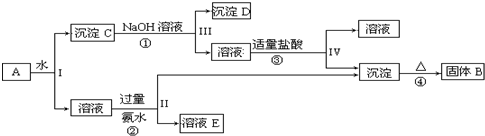
分析 (1)碳酸钠能和稀盐酸反应生成二氧化碳气体,氯化钠和稀盐酸不反应,所以可以用稀盐酸鉴别二者;
(2)碳酸氢钠能和稀盐酸反应生成二氧化碳、氯化钠和水,所以可以用稀盐酸除去氯化钠中的碳酸氢钠;
(3)碳酸氢钠加热时分解生成碳酸钠、水和二氧化碳,所以可以用加热方法除去碳酸钠中的碳酸氢钠;
(4)KAl(SO4)2是强电解质,在水溶液中完全电离生成K+、Al3+、SO42-,铝离子水解生成的氢氧化铝胶体能吸附水中悬浮物而净水.
解答 解:(1)碳酸钠能和稀盐酸反应生成二氧化碳气体,氯化钠和稀盐酸不反应,所以可以用稀盐酸鉴别二者,离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:稀盐酸;CO32-+2H+=CO2↑+H2O;
(2)碳酸氢钠能和稀盐酸反应生成二氧化碳、氯化钠和水,所以可以用稀盐酸除去氯化钠中的碳酸氢钠,离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:稀盐酸;HCO3-+H+=CO2↑+H2O;
(3)碳酸氢钠加热时分解生成碳酸钠、水和二氧化碳,所以可以用加热方法除去碳酸钠中的碳酸氢钠,反应方程式为,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4)KAl(SO4)2是强电解质,在水溶液中完全电离生成K+、Al3+、SO42-,电离方程式为KAl(SO4)2=K++Al3++2SO42-,铝离子水解生成的氢氧化铝胶体能吸附水中悬浮物而净水,所以其用途为净水,
故答案为:KAl(SO4)2=K++Al3++2SO42-;净水.
点评 本题考查除杂、离子方程式的书写、电离方程式的书写等知识点,为高频考点,侧重考查学生分析判断及知识运用能力,明确物质性质差异性是解本题关键,难点是除杂剂的选取,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
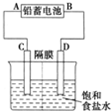 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=-114.6kJ/mol | |
| B. | KOH(s)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O (l);△H=-57.3 kJ/mol | |
| C. | 2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=-114.6 kJ/mol | |
| D. | KOH(aq)+$\frac{1}{2}$ H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O (l);△H=-57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热必须看反应物和生成物所具有总能量的相对大小 | |
| D. | 吸热反应在一定的条件下也能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a可能等于b | B. | a一定大于b | C. | a可能大于b | D. | a一定等于b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:4 | C. | 9:8 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水:2H2O $\frac{通电}{\;}$2H2↑+O2↑ | |
| B. | 焦炭与水蒸气反应:C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO | |
| C. | 太阳光分解水:2H2O$\frac{TiO_{2}}{太阳光}$2H2↑+O2↑ | |
| D. | 天然气与水蒸气反应:CH4+H2O $\frac{高温}{\;}$CO+3H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48 L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4 g SO2中含有的氧原子数目为0.2NA | |
| C. | 1 L 0.1 mol•L-1 K2CO3溶液中含有的钾离子数目为0.1 NA | |
| D. | 100 mL 1.0 mol•L-1 FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com