
| A. | 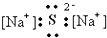 | B. |  | C. |  | D. |  |
分析 A、硫化钠中存在钠离子和硫离子,钠离子直接用离子符号表示,硫离子需要标出最外层电子及所带电荷;
B、NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子;
C、氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
D、水为共价化合物,不存在阴阳离子.
解答 解:A、Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ,故A错误;
,故A错误;
B、NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,故B正确;
,故B正确;
C、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故C错误;
,故C错误;
D、H2O为共价化合物,分子中没有离子,电子式为
点评 本题考查电子式的书写,题目难度不大,注意电子式的书写方法,注意离子和原子、分子电子式的不同.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
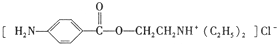 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: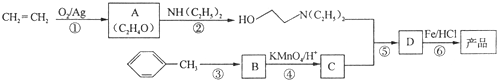
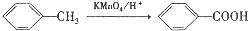
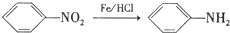
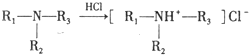
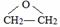 .
.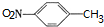 ,C中含氧官能团的名称为硝基、羧基.
,C中含氧官能团的名称为硝基、羧基.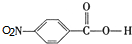 +HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$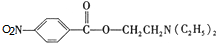 +H2O.
+H2O.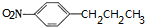 (任写一种).
(任写一种).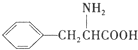 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式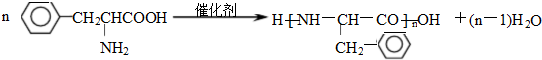 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
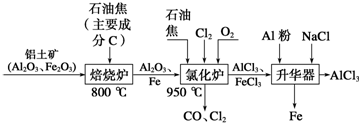
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101k Pa时,1mol C与适量O2 反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l),△H=-57.31 kJ•mol-1.若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol的-OH含有的电子数为NA | |
| B. | 9.2 g甲苯分子中处于同一平面的原子数最多为1.3NA | |
| C. | 标准状况下,2.8 g乙烯分子中含有的单键数为0.5NA | |
| D. | 标准状况下,2.24 L戊烷所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
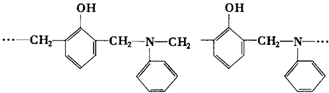
| A. | 2种,取代和加聚反应 | B. | 2种,加成和缩聚反应 | ||
| C. | 3种,取代和加聚反应 | D. | 3种,加成和缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>c(CH3COO-) | B. | c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | c(Na+)<c(CH3COO-) | D. | c(Na+)<c(CH3COO-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com