
X、Y、Z、M、G五种元素分属三个不同短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。Y2是空气的主要成分之一。请回答下列问题:
(1)M在元素周期表中的位置为________________ 。
(2)Y、Z的单质或两元素之间形成的化合物共有________种;Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 (写出两种物质的化学式)
(3)上述五种元素中两元素形成的化合物之间可相互反应生成单质M的化学方程式为
。
(4)ZX与水反应放出气体的化学方程式为___________________________ 。
(10分)(1) 第三周期第ⅥA族 (2) 5;Cl2、O3、ClO2
(3) 2H2S + SO2=3S + 2H2O (4)NaH + H2O=NaOH+ H2↑
解析试题分析:X、Y、Z、M、G五种元素分属三个不同短周期,且原子序数依次增大,所以X一定是氢元素。Y、M同主族,可形成MY2、MY3两种分子,Y2是空气的主要成分之一,这说明Y是氧元素,M是硫因素。X、Z同主族,可形成离子化合物ZX,且Z的原子序数大于Y,小于M,所以Z是Na。G的原子序数大于S的,则G是氯元素。
(1)S的原子序数是16,位于周期表中第三周期第ⅥA族。
(2)Y、Z的单质或两元素之间形成的化合物共有5种,分别是Na、O2、O3、Na2O、Na2O2。Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3、ClO2。
(3)上述五种元素中两元素形成的化合物之间可相互反应生成单质M,这说明M在化合物中的化合价分别是正价和负价,满足条件的是SO2和H2S,反应的化学化学方程式为2H2S + SO2=3S + 2H2O。
(4)NaH中H元素的化合价是-1价,易被水中+1价的H氧化生成氢气,反应的化学方程式是NaH + H2O=NaOH+ H2↑。
考点:考查元素推断、元素周期表的价格和常见化学用语的书写等
点评:该题是中等难度的试题,也高考中的常见题型。试题贴近高考,侧重对学生能力的培养。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。


科目:高中化学 来源: 题型:填空题
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
| A | |
| | C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、T是元索周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X是地壳中含量最多的元素 |
| Y | Y元素原子核外3p能级上有4个电子 |
| Z | 核素Z的质量数为14、中子数为7 |
| T | T的单质是一种常见的金属,其新制的氢氧化物悬浊液可用于检验糖尿病 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是___。
| A.14N与15N为同种核素 |
| B.14N的第一电离能小于14C |
| C.15NH3与14NH3均能形成分子间氢键 |
| D.CH315NH2与CH3CH214NH2互为同系物 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为 。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。请回答下列问题:
(1)青铜的主要组成元素是铜元素和锡元素,请写出锡原子的价电子排布式 。
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,此物质中含有的化学键类型为 ,SO2—4的立体构型是 ,其中S原子的杂化轨道类型是 。
(3)N、O、F三种元素的电负性由大到小的顺序为 ,Cu2O的熔点高于Cu2S,请解释原因: 。
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为 。
(5)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g.cm-3,据此计算阿伏加德罗常数为 [列式并计算,结果用科学记数法表示,保留两位小数,己知Ar(Cu)=63.6]。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物
请填空:
(1)X、Y、Z原子最外层电子数之和是________
(2)X2W的结构式是________
(3)X、Y和Z组成的一种化合物是强酸.写出该酸的稀溶液与铜反应的离子方程式:
________________________________________________________________________
含Y、Z的气体和一种只含X、Z的液体(在常温、常压下)反应可以生成一种离子化合物其化学式为________
(4)X、Y、Z和W组成一种化合物,其原子个数之比为5∶1∶3∶1;该化合物具有
还原性。
① 写出该化合物与过量稀NaOH溶液反应的离子方程式:
________________________________________________________________________.
② 请设计实验证明该化合物具有还原性:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题: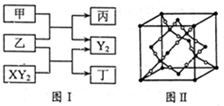
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中, 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
碳、氮、氧是构成生命物质的三种主要元素。
(1)碳、氮、中,原子核外电子未成对电子数最多的是 (用元素符号表示)。
(2)已知CN-与N2结构相似,则HCN分子中σ键与π键数目之比为 。
(3)H2O2分子中氧原子的杂化方式为 。
(4)与NO2+互为等电子体的微粒有 、 (举2例),NO3-的空间构型是 。
(5)已知元素A的氧化物的晶胞结构如图所示,则该氧化物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com