
����Ŀ����Ӧ 3A(g)+2B(g)![]() xC(g)+2D(g)�����е������仯����ͼ��ʾ���ش��������⡣
xC(g)+2D(g)�����е������仯����ͼ��ʾ���ش��������⡣
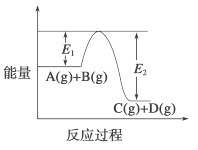
��1������Ӧ�ﵽƽ��ʱ�������¶ȣ�A ��ת����______����������������С���� ������������ԭ����______��
��2����Ӧ��ϵ�м�������Է�Ӧ���Ƿ���Ӱ�죿__________���������¶ȷ�Ӧ�������� E1�ı仯�ǣ� E1_________������������������С����������������
��3����һ�������£��� 2 mol A �� 2 mol B ������ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)+ 2D(g)��2 minĩ��Ӧ�ﵽƽ��״̬ʱ������0.8 mol D��ͬʱ���C��Ũ��Ϊ0.4 mol/L�����ʱ��ƽ�ⳣ��Ϊ________�����������ϵ��ѹǿ����ƽ����ϵ��C�����������______����������������С�������� �����������������Ӧ����ͬ�����´��淴Ӧ��ʼ���У���ʼʱ����C��D��4/3mol��Ҫʹƽ��ʱ�����ʵ����������ԭƽ��ʱ��ȫ��ͬ����Ӧ����______������A��B��C��D��������_______mol ��
xC(g)+ 2D(g)��2 minĩ��Ӧ�ﵽƽ��״̬ʱ������0.8 mol D��ͬʱ���C��Ũ��Ϊ0.4 mol/L�����ʱ��ƽ�ⳣ��Ϊ________�����������ϵ��ѹǿ����ƽ����ϵ��C�����������______����������������С�������� �����������������Ӧ����ͬ�����´��淴Ӧ��ʼ���У���ʼʱ����C��D��4/3mol��Ҫʹƽ��ʱ�����ʵ����������ԭƽ��ʱ��ȫ��ͬ����Ӧ����______������A��B��C��D��������_______mol ��
���𰸡� ��С �÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ� �� ��С 1/2 ���� B���� 4/3mol
����������1����ͼ����Կ�����Ӧ�����������������������������÷�Ӧ������ӦΪ���ȷ�Ӧ�����������¶ȣ���Ӧ�����ƶ�����A��ת���ʼ�С����2�������ܼӿ췴Ӧ���ʵ����ı�ƽ����ƶ������Է�Ӧ�Ȳ��䣬�����¶ȷ�Ӧ�������������E1��С����3�����ڷ�Ӧ
3A��g��+B��g��xC��g��+2D��g��
��ʼŨ�ȣ�mol/L�� 1 1 0 0
ת��Ũ�ȣ�mol/L�� 0.6 0.2 0.4 0.4
ƽ��Ũ�ȣ�mol/L�� 0.4 0.8 0.4 0.4
��x=2��K=c 2(C)c 2(D)/c 3(A)c2(B)=0.42��0.42/0.43��0.8=1/2����Ӧ�������������ķ�Ӧ������ѹǿ��ƽ�ⲻ�ƶ�����ƽ����ϵ��C������������䣻���������Ӧ����ͬ�����´��淴Ӧ��ʼ���У���ʼʱ����C��D��4/3mol��Ҫʹƽ��ʱ�����ʵ����������ԭƽ��ʱ��ȫ��ͬ����Ϊ��Чƽ�⣬��Ӧǰ������������䣬����ѧ������ת������ߣ�����n��A����n��B��=1��1���ɡ�����3A��g��+B��g��2C��g��+2D��g����֪��C��D��4/3mol��ת������߿ɵ�A��2mol��B��2/3mol����Ҫ����B���ܴﵽ��ͬ��ƽ��״̬��B�����ʵ���Ϊnmol����2mol����n+2/3��mol=2mol��2mol�����n=4/3��


 �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д� ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��Ϊ������Ԫ�أ����ǵ�ԭ���������ε����� A�������Ϊһ�����ӵķǽ���Ԫ�أ�C ԭ�ӵ������������Ǵ�����3���� C��D���γ����ֹ�̬���������һ��Ϊ����ɫ���壻B��C���γɶ�����̬�����A��B��C����Ԫ�ؿ����γ����Ӿ��壬�þ����и�Ԫ��ԭ�ӵ����ʵ���֮��ΪA:B:C=4:2:3����ش��������⣺
(1)д��B��ԭ�ӽṹʾ��ͼ ��д��C��D�γɵĵ���ɫ���廯����ĵ���ʽ ��
(2)Ԫ��ԭ�ӵ����ʵ���֮��ΪA:B:C="4:" 2:3 �ľ�������Ϊ �� ��ˮ��Һ�� �ԣ��䷴Ӧ�����ӷ���ʽΪ ��
(3)��д��A2C��BA3�����е�������ͬ��������A��B��CԪ������������Ԫ����ɵ����ķ��ţ��������� �� ��
(4)д����B��CԪ�������Ԫ��ԭ��������ΪB:C=7:12�Ļ�����Ļ�ѧʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ������������ȷ����
A. �����˶����ǽ��������е��˶���ʽ��
B. ����������ʱ�����������ЧӦ������Ϊ���ӶԹ��ɢ����ɵ�
C. ��������������ֽ�����Բ����ù��˵ķ������뽺�����Һ
D. �����ܷ�����Ӿ�����Խ������ɣ����ڳ��ֵ����ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. ��������Ȼ�̼��Һ��ȥ�����л��е�������ϩ����
B. �������Һ�м���ϡ���ᣬ���ȼ����ӣ���ȴ���ټ�����������Cu(OH)2��Һ�����ȣ�û�к�ɫ�������ɣ�˵�����ۻ�û�з���ˮ��
C. �������ữ��AgNO3��Һ���������Ԫ��
D. ���ȵ�ͭ˿���Ժ��Ҵ������û���Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ԷϾ�п�̵�س���������ѡ���ĺ��̷���(MnO2��MnOOH��MnO������Fe��Pb�ȣ�Ϊԭ���Ʊ��ߴ�MnCl2��xH2O��ʵ���̵��������á��乤���������£�

����a: Mn�Ľ������ǿ��Fe��Mn2+�����������±Ƚ��ȶ���pH����5.5ʱ�ױ�O2������
����b:�����������������pH���±����������ӵ���ʼŨ��Ϊ0.1 mol��L-1)
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
��ʼ����ʱ | 8.1 | 6.5 | 1.9 |
��ȫ����ʱ | 10.1 | 8.5 | 3.2 |
��1������I��Ŀ���ǽ����̡���������Һ1�к��е�������ΪMn2+��Fe3+��Pb2+��H+��
��MnO2��Ũ���ᷴӦ�����ӷ���ʽ��__________________________________��
�ڼ�����Һ1��ֻ��Fe3+����Fe2+�IJ�����������:ȡ������Һ1���Թ��У������ɫK3[Fe(CN)6](���軯��)��Һ�������Ա仯����ȡ������Һ1���Թ��У�___________________________��
��Fe3+��Fe2+ת�����ɣ����ܷ����ķ�Ӧ�У�i.2Fe2++Cl2=2Fe3++2Cl-
ii.4Fe2++O2+4H+=4Fe3++2H2O iii.����
д��iii�����ӷ���ʽ��___________________________��
��2������II��Ŀ���dz��������������ַ�����
i.��ˮ��������Һ1��ϡ�ͣ��ټ�����10%�İ�ˮ�����ˡ�
ii.���շ�������Һ1Ũ���õ��Ĺ�����290��C���գ���ȴ��ȡ����������
��֪�������з�������Ҫ��Ӧ2FeCl3+3O2=2Fe2O3+3Cl2������ʱMnCl2��PbCl2�������仯��
�ٰ�ˮ������ʱ����ҺpHӦ������ _______________֮�䡣
�ڲ�ȫii�еIJ�����____________________��
�����ַ����Ƚϣ���ˮ��������ȱ����_________________________________________��
��3������III��Ŀ���dz�Ǧ��������Լ���______________________��
��4������IV���ù����е�x�IJⶨ���£�ȡm1g��Ʒ�����ڵ�����Χ�м�����ʧȥȫ���ᾧˮʱ��������Ϊm2g����x=________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ������Һ����Ҫ��Mn2+����dz����ɫ��������ɫ����MnO42-(��ɫ)��MnO4-����ɫ����ʽ���ڡ�MnO2������ϡ���ᡣ
��1����8 mL 0.1 mol��L-1�����Ը��������Һ��2 mL l.0mol/L�IJ��ᣨH2C2O4����Һ���Թ��л�ϣ�Ȼ���Թ�����25��ˮԡ�У�KMnO4��ҺŨ����ʱ��仯��ϵ����ͼ��ʾ��
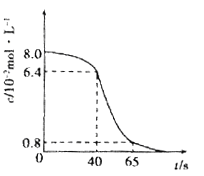
�� д��������Ӧ�����ӷ���ʽ��____________
�� ����ǰ40���ò����ʾ��ƽ����Ӧ����v(����)=________________.
�� 40s-65s�ķ�Ӧ���ʱ�ǰ40s�죬����ԭ��___________
��2����֪��Ӧ3MnO42-+2H2O![]() MnO2+2MnO4-+4OH-��
MnO2+2MnO4-+4OH-��
�� ��MnO4-��Һ�м�������ϡ���ᣬ�ɹ۲쵽��������__________.
�� �����£���0.512 mol/L K2MnO4��Һ�У���pH=14ʱK2MnO4��ת����Ϊ4/9����÷�Ӧ��ƽ�ⳣ����ֵΪ__________
�� ��������������������£��ʵ����������ڽ���K2MnO4��ת���ʣ���÷�Ӧ�ġ�H___0������ڡ� ��С�ڡ����ڡ�����
��3��̼������һ����Ҫ�Ĺ�ҵԭ�ϡ���ҵ�����г��ø��ֽⷨ����MnCO3:
MnSO4+2NH4HCO3=MnCO3��+(NH4)2SO4+CO2��+H2O����Ӧ��ͨ��������Թ�����NH4HCO3���ҿ�����Һ��pHΪ6.8-7.4. ��Һ��pH���ܹ���Ҳ���ܹ��ߣ�ԭ����_______����MnSO4��ҺΪ0.19mol/L������Һ��pH ��߲��ܳ���_________��
[��֪MnCO3��Mn(OH)2��Ksp�ֱ�Ϊl.8��10-11��1.9��10-13]
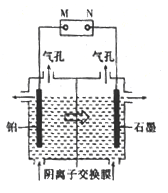
��4���Ʊ������̵�ʵ��װ����ͼ��������ϡ����Ϊ���Һ�������������̺�������ҺΪ���Һ�����װ���С�![]() ����ʾ��Һ���������ƶ��ķ����缫�ĵ缫��ӦʽΪ______��
����ʾ��Һ���������ƶ��ķ����缫�ĵ缫��ӦʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������д������ �� ��
A. ��������ʱ�����д�����������ʱֹͣ���ȣ�������ʹˮ������
B. �������ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ��֧�ܿڴ�
C. ��Һ����ʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
D. ��ȡ����ʱ��Ӧѡ���л���ȡ��������ȡ�����ܶȱ����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����6.48g����C��H��O���л���M,װ��Ԫ�ط���װ��,ͨ��������O2ʹ����ȫȼ��,�����ɵ���������ͨ���Ȼ��Ƹ����A�ͼ�ʯ�Ҹ����B.���A������������4.32g,B��������18.48g����֪���л������Է�������Ϊ108��
(1) ȼ�մ˻�����6.48g,�����������������Ƕ���?
(2) ��˻�����M�ķ���ʽ?
(3) ���л���1��������1����������д��һ������������M�Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com