
【题目】下列装置或操作不能达到目的的是
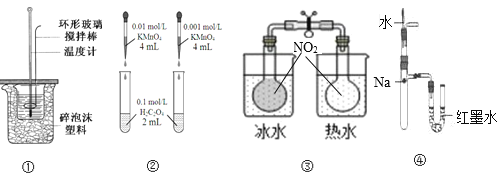
A.装置①用于滴定中和热装置
B.装置②依据褪色快慢比较浓度对反应速率的影响
C.③依据两容器内气体颜色变化,判断反应2NO2(g)![]() N2O4(g)平衡移动的方向
N2O4(g)平衡移动的方向
D.装置④依据U管两边液面的高低判断Na和水反应的热效应
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中-lg c(H+)与-lg c(OH)。关系如图所示。下列说法不正确的是( )
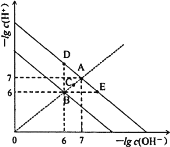
A.图中五点Kw间的关系:B>C>A=D=E
B.A→E点对应的水溶液中,可能有NH4+、Ba2+、Cl、I大量同时存在
C.若0.1mol·L1的NaHA溶液水溶液中c(H+)与c(OH)关系如图D点所示,则溶液中有:c(HA)>c(OH)>c(A2)>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH)关系如图E点所示,则溶液中反应:2H++SO42-+Ba2++2OH=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究大小相同、过量的去膜镁条与40mL0.1mol·L1的盐酸和醋酸分别反应,相同条件下测得气体体积与反应时间关系如下表所示:
气体读数/mL | 5 mL | 10 mL | 15 mL | 20 mL | …… | 45 mL |
A瓶(醋酸)/s | 155 | 310 | 465 | 565 | …… | 865 |
B瓶(盐酸)/s | 7 | 16 | 30 | 64 | …… | 464 |
下列说法不正确的是( )
A.0~5mL时,A与B反应速率不同的原因是c(H+)不同所致
B.5~10mL时,A瓶平均反应速率为![]() mL·s1
mL·s1
C.0~20mL时,A瓶反应速率增大,可能是温度升高所致
D.0~45mL时段内,镁与盐酸反应的速率始终大于镁与醋酸反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了9种元素在周期表中位置,用化学符号回答下列问题。
周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中:化学性质最不活泼的是__;金属性最强的是:__,最高价氧化物的水化物酸性最强的酸是__,最高价氧化物的水化物碱性最强的碱的电子式__。
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是__。
(3)A、B、C三种元素按离子半径由大到小的顺序排列为__。
(4)F的最常见氢化物的电子式__;该氢化物在常温下跟B发生反应的化学方程式是__。
(5)C元素跟G元素形成的化合物的电子式是__,用电子式表示其形成过程为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)═2H2O(g)△H1
3H2(g)+Fe2O3(s)═2Fe(s)+3H2O(g)△H2
2Fe(s)+![]() O2(g)═Fe2O3(s)△H3
O2(g)═Fe2O3(s)△H3
2Al(s)+![]() O2(g)═Al2O3(s)△H4
O2(g)═Al2O3(s)△H4
2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
A.△H1<0,△H3>0B.△H5<0,△H4<△H3
C.△H1=△H2+△H3D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究有机物A 的组成与结构,某同学进行如下实验。
i.0.2 molA 在氧气中完全燃烧后,生成CO2 和H2O 各 0.6 mol。
ii.通过质谱法测得其相对分子质量为 90。
iii.通过红外光谱法测得A 中含有—OH 和—COOH。
iv.A 的核磁共振氢谱图显示四组峰,峰面积之比为 1:1:1:3。
请回答下列问题。
(1)A 的分子式是_____。
(2)A 的结构简式是_____。
(3)已知:RCH2CH2OH![]() RCH=CH2 + H2O,在一定条件下,A有如下转化关系:A
RCH=CH2 + H2O,在一定条件下,A有如下转化关系:A![]() B
B![]() C其中,C是高分子物质,则A转化为B的化学方程式是:_____。C 的结构简式是:_____。
C其中,C是高分子物质,则A转化为B的化学方程式是:_____。C 的结构简式是:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 号中的某元素形成的微粒的结构示意图可表示为
号中的某元素形成的微粒的结构示意图可表示为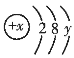 ,其中
,其中![]() 。
。
(1)![]() 表示______,
表示______,![]() 表示______。
表示______。
(2)若该微粒是原子,则![]() 和
和![]() 的数量关系为______。
的数量关系为______。
(3)若该微粒是阳离子,则![]() 和
和![]() 的数量关系为______,该微粒可以是______(写出一种离子符号)。
的数量关系为______,该微粒可以是______(写出一种离子符号)。
(4)若该微粒是阴离子,则![]() 和
和![]() 的数量关系为______,该微粒可以是______(写出一种离子符号)。
的数量关系为______,该微粒可以是______(写出一种离子符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com