
���� ��ȼ�պ�IJ���ͨ��ŨH 2SO 4����ͨ����ʯ�ң�����ǰ������ 10.8g���������� 39.6g���ֱ�Ϊˮ��������̼���������ɼ���0.1mol������C��H��Ŀ������ȷ���л������ʽ�������ܺ�Һ�巴Ӧ��������ʹ���CCl 4��Һ��ɫ��˵������̼̼˫���������ܱ�KMnO 4��H +����Һ������ӦΪ����ͬϵ�0.01mol��������ǡ�ú�0.5mol/L��NaOH��Һ40mL��ȫ��Ӧ����1mol�л�����2mol�������Ʒ�Ӧ��˵������2���Ȼ�����ϱ����ϵ�һ�����ֻ�ж���ȷ���л���Ľṹ��ʽ��
��� �⣺ŨH 2SO 4���յ���H 2O�������ʵ���Ϊ��$\frac{10.8}{18/mol}$=0.6 mol����Hԭ��Ϊ1.2 mol����ʯ�����յ���CO 2�������ʵ���Ϊ $\frac{39.6}{44/mol}$=0.9 mol����Ϊ0.1 mol���к���0.9 mol Cԭ�ӣ�1.2 mol Hԭ�ӣ��������ķ���ʽΪC9H12�����ܱ�KMnO 4��H +����Һ�������ַ���C nH 2n-6��ͨʽ���жϸ���Ϊ����ͬϵ���������Һ�巴Ӧ��������ʹ���CCl 4��Һ��ɫ���ͽ�һ��ȷ��Ϊ����ͬϵ�
����Ϊ0.01 mol��������ǡ�ú�0.5 mol/L��NaOH��Һ40 mL��ȫ�кͣ���Ϊ��Ԫ�ᣬ���ԭ�����Ǵ������������ı���ͬϵ�������  ������ұ�����
������ұ����� ���Լ��ұ��������ڱ����ϵ�һ�����ֻ������ͬ���칹�壬�ʸ���ֻ����
���Լ��ұ��������ڱ����ϵ�һ�����ֻ������ͬ���칹�壬�ʸ���ֻ���� 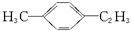 ���Լ��ұ���
���Լ��ұ���
�𣺸����ķ���ʽΪC9H12�������Ľṹ��ʽ�����Ʒֱ�Ϊ�� ������ұ�����
������ұ����� ���Լ��ұ����������ϵ�һ�����ֻ�ж��֣�ӦΪ
���Լ��ұ����������ϵ�һ�����ֻ�ж��֣�ӦΪ ��
��
���� ������Ҫ�������л�����ƶϣ�Ϊ��Ƶ���㣬���ؿ���ѧ���ķ��������ͼ����������ѶȲ�������Ԫ���غ㣬���ݼ����ƶ��л����ǽ���ؼ�������ʱע�ⳣ�������ŵ����ʵ�Ӧ���Լ��л���Ľṹ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
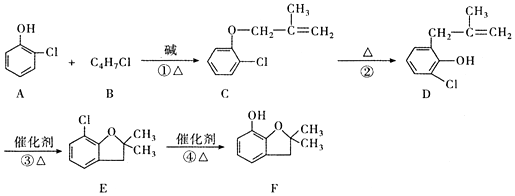
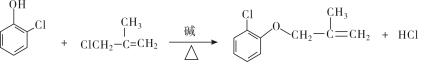 ���л����ýṹ��ʽ��ʾ����ͬ����
���л����ýṹ��ʽ��ʾ����ͬ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
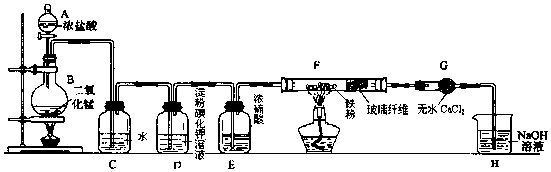
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol/L | B�� | 2 mol/L | C�� | 0.5 mol/L | D�� | 1.5 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
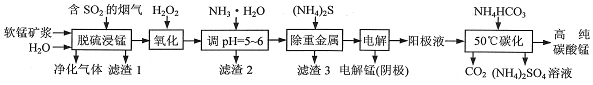
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ��̨�ϵ���ȼ���ױ�ҩƷҪԶ���Դ | |
| B�� | ���Ũ����մ��Ƥ����ӦѸ����Ĩ����ȥ�����ô���ˮ��ϴ�����Ϳ��С�մ���Һ | |
| C�� | ������Һ�ε�ʵ��̨�ϣ���ʪĨ�����ɾ�������ˮ��ϴ | |
| D�� | һ������ʵ��������ֻ��������Ӧ��������ѧУ�쵼��Ȼ����119���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com