
A.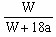 ×100% ×100% | B.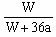 ×100% ×100% |
C.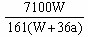 ×100% ×100% | D.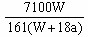 ×100% ×100% |
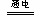 Cu(OH)2↓+H2↑。阴极逸出a mol H2,水被电解了2a mol。而依据溶解度的知识,电解的水与析出的Wg Na2SO4·10H2O晶体应组成该温度下的饱和溶液,故,剩余溶液中溶质的质量分数与电解的水和析出的Wg Na2SO4·10H2O晶体应组成该温度下的饱和溶液质量分数相等,即:
Cu(OH)2↓+H2↑。阴极逸出a mol H2,水被电解了2a mol。而依据溶解度的知识,电解的水与析出的Wg Na2SO4·10H2O晶体应组成该温度下的饱和溶液,故,剩余溶液中溶质的质量分数与电解的水和析出的Wg Na2SO4·10H2O晶体应组成该温度下的饱和溶液质量分数相等,即: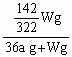 ×100% =
×100% =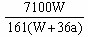 % ;若用铂电极电解时发生的总的反应式为:2H2O
% ;若用铂电极电解时发生的总的反应式为:2H2O 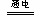 O2↑+ 2H2↑,阴极逸出a mol H2,水被电解了a mol,则剩余溶液中溶质的质量分数为:
O2↑+ 2H2↑,阴极逸出a mol H2,水被电解了a mol,则剩余溶液中溶质的质量分数为: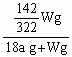 ×100% =
×100% =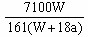 %。
%。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.4×10-3mol·L-1 | B.2×10-3mol·L-1 |
| C.1×10-3mol·L-1 | D.1×10-7mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
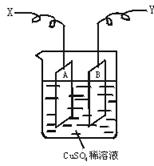
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阴极只析出H2 | B.阳极先析出Cl2,后析出O2 |
| C.电解最后阶段为电解水 | D.溶液的PH值不断增大,最后为7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.062(6.2%)19152 |
| B.0.062(6.2%)15219 |
| C.0.042(4.2%)1.29.4 |
| D.0.042(4.2%)9.41.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业用电解熔融AlCl3的方法制金属铝 |
| B.铜锌原电池中,锌作负极,电子从锌极流向铜极 |
| C.电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应 |
| D.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
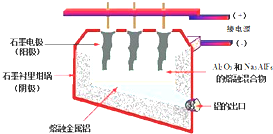
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com