
| A、X、Y、Z元素分别为N、P、O | B、白格中都是主族元素,灰格中都是副族元素 | C、原子半径:Z>X>Y | D、X、Y、Z的气态氢化物中最稳定的是:Z的氢化物 |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| 元素 | 性质或原子结构 |
| A | 原子核内只有一个质子 |
| B | 单质是空气中含量最多的气体 |
| X | 原子的最外层电子数是次外层电子数的3倍 |
| Y | 短周期元素中原子半径最大的元素 |
| Z | 最高正化合价与最低负化合价的代数和为6 |
| ||
| △ |
| ||
| △ |
| 实验操作 | 实验现象 | 结论及解释 |
| ①取少量NaBr 溶液于试管中,滴加 氯水 氯水 ,振荡;②再加入少量CCl4,振荡,静置. |
①溶液由无色变为橙黄色. ②溶液分层, 上层液体几乎为无色,下层液体为橙红色 上层液体几乎为无色,下层液体为橙红色 . |
氧化性:Z 单质>Br2 离子方程式 Cl2+2Br-═2Cl-+Br2 Cl2+2Br-═2Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
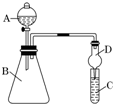 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市三峡名校联盟高一下学期期中考试化学试卷(带解析) 题型:填空题
下表是元素周期表的一部分,表中所列字母分别代表一种元素。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | A | | | | | | |
| 二 | | | | B | C | D | E |
| 三 | F | | G | H | | I | K |
| 四 | J | | | | | | L |

查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省佛山市高三一模理综化学试卷(解析版) 题型:选择题
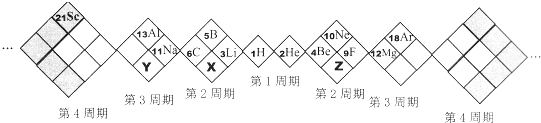
某同学设计如下元素周期表,以下说法正确的是
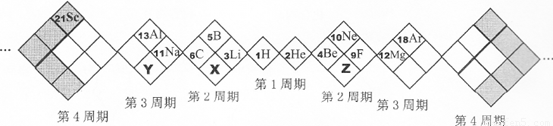
A.X、Y、Z元素分别为N、P、O
B.白格中都是主族元素,灰格中都是副族元素
C.原子半径:Z>X>Y
D.X、Y、Z的气态氢化物中最稳定的是:Z的氢化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com