
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
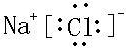 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.分析 (1)由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He;
(2)稀有气体化学性质最不活泼;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;
(4)根据同主族自上而下原子半径增大判断;
(5)元素⑥的氢化物为NH3;氨气的水溶液呈碱性;
(6)元素钠与元素氯形成的化合物氯化钠,氯化钠的电子式为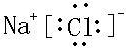 ,高温下灼烧该化合物火焰呈黄色;
,高温下灼烧该化合物火焰呈黄色;
(7)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al;
解答 解:(1)由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He,
故答案为:①H、②Na、③Mg、④Al、⑤K、⑥N、⑦F、⑧Cl、⑨Br、⑩He;H;Mg;Cl;
(2)稀有气体He的化学性质最不活泼,
故答案为:He;
(3)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH;
(4)同主族自上而下原子半径逐渐增大,故三者的原子半径大小为:K>Na>H,
故答案为:K>Na>H;
(5)元素⑥的氢化物为NH3;氨气的水溶液呈碱性,所以所得溶液的pH大于7,故答案为:NH3;>;
(6)元素钠与元素氯形成的化合物氯化钠,氯化钠的电子式为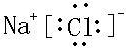 ,高温下灼烧该化合物火焰呈黄色,故答案为:
,高温下灼烧该化合物火焰呈黄色,故答案为: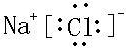 ;黄;(7)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al,故答案为:Al.
;黄;(7)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al,故答案为:Al.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,熟练掌握原子结构与元素周期表、元素周期律的关系为解答关键,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 2.5 ax/b | B. | 5.6 ax/b | C. | 11.2 ax/b | D. | 22.4 ax/b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10B20为硼元素的一种原子 | B. | 10B20为硼元素的一种单质 | ||
| C. | 10B的中子数比核外电子数多 | D. | 10B的原子核外电子排布为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
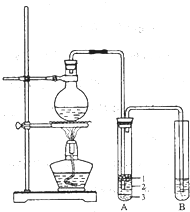 某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:| 乙醇 | 溴乙烷 | |
| 状态 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用盖斯定律可计算某些难以直接测量的反应焓变 | |
| B. | 如果一个热化学方程式可通过其他几个热化学方程式相加减而得到,则该反应的焓变可由相对应的热化学方程式的焓变相加减而得到 | |
| C. | 当同一个化学反应以不同的途径完成时,反应的焓变也是不同的 | |
| D. | 对于放热反应,放出的热量越多,焓变越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
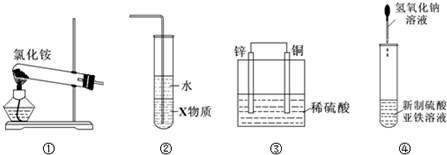
| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③是原电池,锌电极为负极,发生还原反应 | |
| D. | 装置④可用于制备氢氧化亚铁并观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
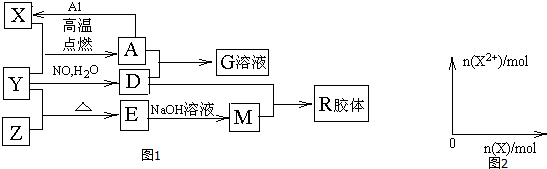
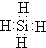 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com