(2009?徐州三模)控制、治理氮氧化物对大气的污染是改善大气质量的重要方面.
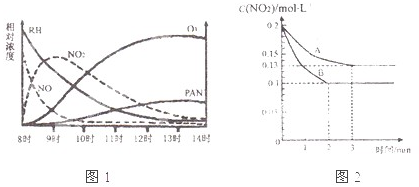
(1)光化学烟雾白天生成,傍晚消失,其主要成分为RH(烃)、NO、NO
2、O
3、PAN(CH
3COOONO
2),某地早上至中午这些物质的相对浓度变化如图1所示,则下列叙述合理的是
a.b
a.b
.(填字母)
a.早上8时交通繁忙期,光化学烟雾的主要成分为RH、NO
b.14时,光化学烟雾的主要成分为O
3、PAN
c.PAN、O
3由RH和NO直接反应生成
d.PAN直接由O
3转化生成
(2)火力发电厂的燃煤排烟中含大量的氮氧化物(NOx),可利用甲烷和NOx在一定条件下反应消除其污染,则CH
4与NO
2反应的化学方程式为
CH4+2NO2=N2+CO2+2H2O
CH4+2NO2=N2+CO2+2H2O
.
(3)在一密闭容器中发生反应2NO
2 ?2NO+O
2,反应过程中NO
2的浓度随时间变化的情况如图2所示.请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
0.0117mol/(L?min)
0.0117mol/(L?min)
.
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件是
温度
温度
(填“浓度”、“压强”、“温度”或“催化剂”).
③曲线A、B分剐对应的反应平衡常数的大小关系是K
A<
<
K
B.(填“>”、“<”或“=”)
(4)一定温度下,在一密闭容器中N
2O
5可发生下列反应:
2N
2O
5(g)?4NO
2(g)+O
2(g)I
2NO
2(g)?2NO(g)+O
2(g)II
则反应I的平衡常数表达式为
.若达平衡时,c(NO
2)=0.4mol?L
-1,c(O
2)=1.3mol?L
-1,则反应II中NO
2的转化率为
80%
80%
,N
2O
5(g)的起始浓度应不低于
1
1
mol?L
-1.




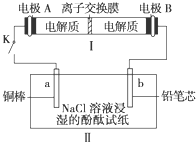 (2009?徐州三模)如图所示装置I是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3
(2009?徐州三模)如图所示装置I是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 (2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.