
常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)根据下图图示判断,下列说法正确的是( )
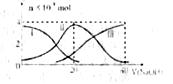 A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH可能增大也可能减小
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
有机物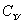 H3
H3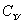 H===CH—
H===CH—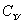 ≡CH中标有“·”的碳原子的杂化方式依次为 ( )
≡CH中标有“·”的碳原子的杂化方式依次为 ( )
A.sp、sp2、sp3 B.sp2、sp、sp3 C.sp3、sp2、sp D.sp3、sp、sp2
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,
待合金完全溶解后,收集到6.72L(标准状况)NO和NO2的混合气体,并测得溶液中H+浓度为1mol/L。
假设反应后溶液的体积仍为80mL,试计算.
(1)被还原硝酸的物质的量。
(2)合金中银的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏伽德罗常数的述职,下列说法中正确的是( )
A、在标准状况下,33.6LSO3中含有的氧原子数是4.5NA
B、两份均为2.7g的铝样品分别为100mL浓度均为2mol·L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3 NA
C、常温常压下, 和
和 的混合气体中所含共用电子对数目为3a/14·NA
的混合气体中所含共用电子对数目为3a/14·NA
D、6.0g金刚石中含有的共价键数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修3:物质结构与性质](15分)
有A、B、C、D、E、F、G、H原子序数递增的前四周期八种元素。请根据下列信息,回答问题:
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为 |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个外成对电子; |
| ⑦H能形成红色(或砖红色)的 |
(1)G元素基态原子的价电子排布图为 。
(2)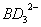 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。
(3)根据等电子体原理,推测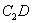 分子的空间构型为 。
分子的空间构型为 。
(4)下列有关E、F的叙述正确的是( )
a.离子半径E>F b.电负性E<F
c.单质的熔点E>F d. E、F的单质均能与氧化物发生置换
e. E的氧化物具有两性 f. E、F均能与氯元素构成离子晶体
(5)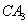 极易溶于
极易溶于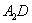 ,原因是 。
,原因是 。
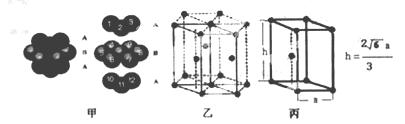
(6)E单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,晶胞如下图丙所示。则E单质的晶体堆积模型为 。
若已知E原子半径为r pm,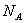 表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和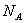 代数式表示)
代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应A (g)+ 3B(g) = 2C(g) + 2D(g),下列数据表示反应进行得最快的是( )
A.v(A)=0.7mol/(L·s) B.v (B) =1.8mol/(L · s)
C.v (C)=1mol/(L·s) D.v (D) =1.6mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e- ="=" 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
(1)将反应Zn + 2H+ = Zn2+ + H2↑拆写为两个“半反应式”:其中,氧化反应为: 。
(2)由题(1)反应,设计成原电池如图所示:
若电极a为Zn ,电极b可选择材料: (只填一种);电解质溶液甲是 ;电极b处的电极反应式: 。
(3)由反应2H2 + O2 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。
2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作不能达成实验目的的是( )
A.溴乙烷与氢氧化钠溶液共煮后,加入硝酸银检验Br-
B.用电石和饱和食盐水制取乙炔
C.用苯、2mol/L的硝酸制硝基苯
D.用四氯化碳萃取碘水中的碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com