
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组同学用下右图装置进行实验,试回答下列问题。
⑴若开始时开关K与a连接,则B极的电极反应式为
。
⑵若开始时开关K与b连接,总反应的离子方程式
为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电
解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中
转移0.2 mol电子
⑶该小组同学模拟工业上用离子交换膜法制烧碱
的方法,那么可以设想用右图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。
此时通过阴离子交换膜的离子数 (填“大于”
或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、
“C”、“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述
原因 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三3月摸底考试理综化学试卷(解析版) 题型:填空题
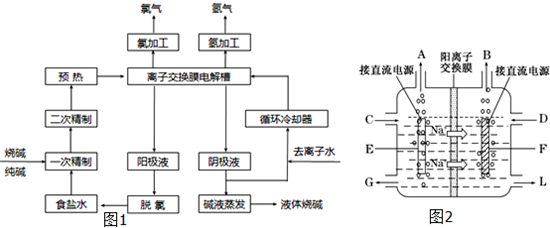
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:

(1)该流程中可以循环的物质是??????????? 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式???? ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果??? 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是? ????? ? ,E电极的名称是???? 。电解总反应的离子方程式为???????? 。

(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为??????????? 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为??????????? 。
查看答案和解析>>
科目:高中化学 来源:2010年浙江江山实验中学高二年级5月月考化学试卷 题型:
某课外活动小组同学用下右图装置进行实验,试回答下列问题。

⑴若开始时开关K与a连接,则B极的电极反应式为
。
⑵若开始时开关K与b连接,总反应的离子方程式
为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电
解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中
转移0.2 mol电子
⑶该小组同学模拟工业上用离子交换膜法制烧碱
的方法,那么可以设想用右图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。
此时通过阴离子交换膜的离子数 (填“大于”
或“小于”或“等于”)通过阳离子交换膜的离子数。

②制得的氢氧化钾溶液从出口(填写“A”、“B”、
“C”、“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述
原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com