
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图:回答下列问题:

(1)CO和NaOH在一定条件下合成甲酸钠,甲酸钠加热脱氢的化学反应方程式分别为:____、____ 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是____ ;过滤操作②的滤液是 和 ,滤渣是____ 。
(3)工艺过程中③和④的目的是____ 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是___ 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMn04溶液滴定,至浅粉红色不消褪,消耗KMn04溶液15.00 mL,反应的离子方程式为____ ;
列式计算该成品的纯度 。

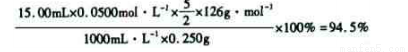
【解析】
试题分析:⑴CO和NaOH在一定条件下合成甲酸钠的反应可用观察法将其配平;甲酸钠加热脱氢(产生H2),通过观察法并结合原子守恒得另一生成物为Na2C2O4。
⑵根据“钙化”反应:Na2C2O4+Ca(OH)2=CaC2O4↓+2NaOH,由此可确定过滤操作①的滤液是NaOH,滤渣是CaC2O4;根据“酸化”反应:CaC2O4+H2SO4=CaSO4+ H2C2O4,由此可确定过滤操作②的滤液是H2C2O4,滤渣是CaSO4;
⑶该工艺过程中③和④(“回头”)分别循环利用氢氧化钠和硫酸,减小污染,也可降低成本。
⑷若在甲酸钠脱氢后生成的Na2C2O4中直接用硫酸酸化制备草酸,会产生Na2SO4杂质。
⑸根据得失电子守恒有5C2O42-+2MnO4-――2Mn2++10CO2↑,再根据电荷守恒有5C2O42-+2MnO4-+16H+――2Mn2++10CO2↑,最后根据原子守恒得5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;最后根据该反应方程式建立关系式“5(H2C2O4·2H2O)~2KMnO4”,得该成品的纯度为:
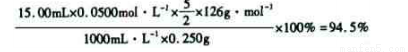 。
。
考点:本题以“草酸晶体的工业制备流程图”为素材考查反应方程式的书写与分析、物质的循环利用及化学计算。


科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是( )
A.10 min内,T1时CH4的化学反应速率比T2时小 B.温度:T1<T2
C.ΔH:a < 0 D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省盟校高三第二次联考理综化学试卷(解析版) 题型:选择题
化学与科技、生产、生活密切相关。下列说法正确的是( )
A.气象环境报告中的“PM2.5”是对一种新分子的描述
B. 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应
C.“玉兔号”月球车太阳能电池帆板的材料是二氧化硅
D.地沟油的主要成分是油脂,其组成与汽油、煤油不相同
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:填空题
(15分)某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2 g苯甲酸和20 mL甲醇(密度约为0.79 g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
⑴浓硫酸的作用是________________________________________ _________;
若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式
___________________________________________________。
⑵甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲 酯的装置 (夹持仪器和加热仪器均已略去)。
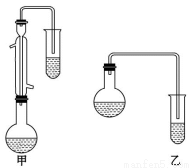
根据有机物的沸点,最好采用______(填“甲”或“乙”)装置。
理由是______________________________________________。
⑶若要提高苯甲酸甲酯的产率,可采取的措施_
______ _。(任写一条)
Ⅱ.粗产品的精制
⑷苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称。

⑸通过计算,苯甲酸甲酯的产率为__________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.根据反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
B.根据反应H3PO3+2NaOH(足量)===Na2HPO3+2H2O可知:H3PO3属于三元酸
C.根据反应3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
D.根据反应CuSO4+H2S===CuS↓+H2SO4可知:H2S的酸性比H2SO4强
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省宜春市高三模拟考试理综化学试卷(解析版) 题型:选择题
乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如下:

下列叙述正确的是 ( )
A.该反应不属于取代反应
B.乙酸香兰酯的分子式为C10H8O4
C.FeCl3溶液可用于区别香兰素与乙酸香兰酯
D.乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:实验题
(10分)在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差。
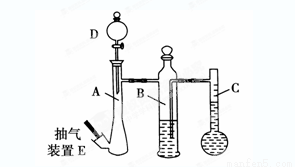
(1)若称取0.113g镁带与10.00 mL稀硫酸(足量)完全反应制取氢气,并测定1mol H2的体积(在常温常压下测定)。反应结束时C中的液面刻度为128.00 mL(A中未加硫酸时C中无液体),则得此条件下1mol H2的体积为________L(精确到0.001)。
(2)上述测出1mol H2的体积比该温度和压强下的理论值偏高的原因是(假设操作和装置都无问题)________(选填编号,下同)
A.未冷却到室温 B.反应太快
C.装置气密性不好 D.B装置漏气
(3)若利用上述装置测定CO2的气体摩尔体积。
①B中所盛放的液体应为________。
A.饱和Na2CO3溶液 B.饱和NaHCO3溶液
C.水 D.澄清石灰水
②仪器A、D中盛放的试剂应为________。
A.大理石,浓盐酸 B.纯碳酸钠,稀硫酸
C.纯碳酸钙,稀硫酸 D.纯碳酸钠,稀盐酸
(4)用以上装置测出的气体摩尔体积均比理论值大,你认为减小实验误差可行的措施是_______。
A.把A装置浸入盛水(常温)的水槽中
B.减小酸的浓度
C.把A装置浸入盛热水的水槽中
D.增大酸的浓度
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各组中两种微粒所含电子数不相等的是
A.H3O+和OH- B.CO和N2 C.HNO2和NO2- D.CH3+和NH4+
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
现有一块金属钠露置于空气中一段时间,为检验该固体是否部分变质为碳酸钠,先将固体样品溶解于水得到溶液,并采取下列措施,可以实现实验目的的是
A.测所得溶液的pH
B.取溶液滴入酚酞观察是否变红
C.取溶液加入盐酸观察是否有气泡
D.取溶液加入CuSO4观察是否有沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com