
| A、KX、KZ、KY |
| B、KX、KY、KZ |
| C、KZ、KY、KX |
| D、KY、KZ、KX |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | C | |
| B |
| A、B的氧化物对应的水化物一定为强酸,且只有氧化性 |
| B、三种元素对应的氢化物中C的氢化物稳定性最好 |
| C、原子半径大小关系为:C>A |
| D、C的单质常温下为无色无味的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
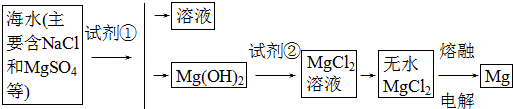
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲是第ⅠA元素,丙是第VⅡA元素 |
| B、甲、丙形成的化合物是离子化合物 |
| C、乙的最高价氧化物是两性氧化物 |
| D、丙是元素周期表中非金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将水加热,KW增大,pH不变 |
| B、向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
| C、向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D、向水中加入少量NaHSO4固体,c(H+)增大,KW不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
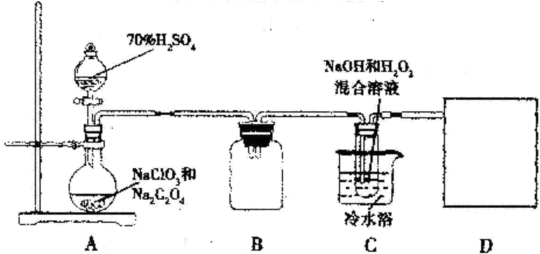
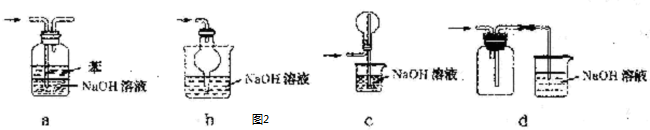
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com