
【题目】请回答下列问题:

(1)①和③形成的化合物类型为_______ (填“离子”或“共价”)化合物。
(2)元素①的失电子能力比元素⑥_______(填“强”或“弱”),试从原子结构方面解释其原因_______。
(3)⑥单质与氧化铁高温下反应的方程式是______________;工业冶炼⑥的哝璜的化学方程式是________。
⑥的单质与浓NaOH溶液反应的离子方程式是_____________。
(4)实验室现有元素①的单质和⑥的单质,请简要写出比较两者活动性强弱的一种实验方案_________
【答案】 离子 强 镁原子半径大于铝,原子核对最外层电子的吸引力比铝弱,比铝原子更易失去电子,所以镁元素金属性比铝强 2Al+Fe2O3===2Fe+Al2O3 2 Al2O3(熔融)===4Al+3O2 2Al+2OH-+2H2O=2AlO2-+3H2↑ 在两个烧杯中分别加入适量的等浓度的盐酸,然后将形状大小相同的镁、铝单质放入烧杯中,镁与盐酸反应更剧烈,故镁的金属性强。
【解析】根据同周期元素的原子半径从左向右逐渐减小,同主族元素的原子半径从上到下逐渐增大以及元素最高价和最低价的计算方法判断出元素,然后结合元素周期律及相应单质、化合物的性质分析解答。
根据表中数据可知①和⑤化合价均为+2价,则为第IIA族元素,而且半径①>⑤,则①为Mg元素,⑤为Be元素;②和⑥化合价均为+3价,则为第IIIA族元素,而且半径⑥>②,则⑥为Al元素,②为B元素;③的化合价为+7、-1价,则为第VIIA族,F没有正价,则为Cl;④的化合价为+4、-4价,则为第IVA族,原子半径比Cl的大,则为Si元素;
(1)①和③形成的化合物为氯化镁,构成微粒为离子,则属于离子化合物;(2)①为Mg元素、⑥为Al元素,同周期元素的金属性从左向右在减小,则Mg的金属性比铝的强,是因为镁的原子半径大于铝,原子核对最外层电子的吸引力比铝弱,比铝原子更容易失去电子,所以镁元素的金属性比铝要强;(3)铝单质与氧化铁高温下反应的方程式是2Al+Fe2O3![]() 2Fe+Al2O3;工业上通过电解熔融的氧化铝冶炼金属铝,方程式为2Al2O3(熔融)
2Fe+Al2O3;工业上通过电解熔融的氧化铝冶炼金属铝,方程式为2Al2O3(熔融)![]() 4Al+3O2↑;Al与NaOH溶液反应的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑;(4)利用不同金属与水或与酸反应,反应剧烈的金属性强,则在两个烧杯中分别加入适量的等浓度的盐酸,然后将形状大小相同的镁、铝单质放入烧杯中,镁与盐酸反应更剧烈,故镁的金属性强。
4Al+3O2↑;Al与NaOH溶液反应的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑;(4)利用不同金属与水或与酸反应,反应剧烈的金属性强,则在两个烧杯中分别加入适量的等浓度的盐酸,然后将形状大小相同的镁、铝单质放入烧杯中,镁与盐酸反应更剧烈,故镁的金属性强。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.NH4+ 、SO42- 、Al3+ 、NO3- B.Na+ 、K+ 、HCO3- 、NO3-
C.Na+ 、Ca2+ 、NO3- 、CO32- D.K+、Cu2+ 、NH4+ 、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与氨反应,研究氨的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
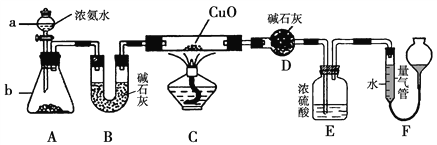
(1)仪器a的名称为____________。
(2)实验室中,利用装置A,还可制取的无色气体是____________(填字母)。
A.Cl2 B.O2
C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管内有无色无味的气体生成,上述现象证明氨气具有________性,写出相应的化学方程式___________________。
(4)E装置中浓硫酸的作用_________________。
(5)读取气体体积前,应对装置F进行的操作______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2CO(g)=2C(s)+O2(g)。设△H和△S不随温度而变,下列说法中正确的是
A.低温下是能自发进行 B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行 D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别方法不可行的是( )
A. 用水鉴别乙醇、甲苯和溴苯
B. 用燃烧法鉴别乙醇、苯和四氯化碳
C. 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D. 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法不可以用来实验室制备气体的是
A. 电解硫酸钠溶液制氢气 B. 双氧水和二氧化锰反应制氧气
C. 高锰酸钾与浓盐酸反应制氯气 D. NH4HCO3受热易分解制CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式表示正确的是
A. 用惰性电极电解NaCl溶液2H2O+2Cl-![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 铜片跟三氯化铁溶液反应:Fe3++Cu=Cu2++Fe2+
C. 用FeSO4除去酸性废水中Cr2O72-:Cr2O72-+6Fe2++7H2O =2Cr3++6Fe3++14OH-
D. Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: C>Si | |
B | 食盐水 | 电石 | 溴水 | 乙炔可与溴发生加成反应 | |
C | 浓硝酸 | Al | NaOH溶液 | 铝和浓硝酸反应可生成NO2 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | SO2具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A.3.2gO2和O3的混合物中含有的氧原子数目为0.2NA
B.![]() 的醋酸溶液中含有氢离子数目为0.1NA
的醋酸溶液中含有氢离子数目为0.1NA
C.标准状况下,2.24LCCl4含碳原子数目为0.1NA
D.将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com