
����Ŀ���ݹ۹Ž�,��ѧ�����������������ϵ������˵����ȷ���ǣ� ��
A.������ͼ�������̷������:���Ǵ˷�ɫ��,ζ��,��֮�������������Ϊ�̷��ܵ����H+,������ζ����
B.��˾��֮�(��),Ͷ֮�ڵ�,����(�ױ�)ָ����,˾����������IJ���ΪFe2O3
C.�������ܼ����ʳ�Σ�ֻ������ˮ���ܡ�
D.����κ�����ڡ����ײ�ͬ�����жԹ�������:�������û����,��������,������֮,��ѿΪ���������������ѿ����ָ���

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա���Ƴ�һ���������ɺ�����Na��CO2��ء��ŵ�ʱ�õ����������CO2�����ʱ��������CO2������CO2ʱ���乤��ԭ����ͼ��ʾ�����յ�ȫ��CO2�У���![]() ת��ΪNa2CO3��������ڶ��̼���ܣ�MWCNT���缫���档����˵����ȷ���ǣ� ��
ת��ΪNa2CO3��������ڶ��̼���ܣ�MWCNT���缫���档����˵����ȷ���ǣ� ��
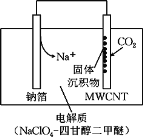
A.��������CO2ʱ��������Ӧ��4Na++ 3CO2+ 4e��= 2Na2CO3+ C
B.��������CO2ʱ���Ʋ�Ϊ����
C.��������CO2ʱ��Na+����̼���ܵ缫�ƶ�
D.��״���£�ÿ��������22.4 L CO2��ת�Ƶ�����Ϊ0.75 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���顢ϩ��Ȳ���dz�����̼�⻯���
(1)д�������л����ϵͳ���������ƣ�
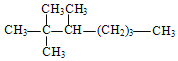 ������_____
������_____
(2)�������л����CH3CH3 ��CH2��CH2 ��CH3��CH2��C��CH ��CH3��C�� C��CH3 ��C6H12 ��CH3��CH��CH2�����л�Ϊͬϵ�����_____����Ϊͬ���칹�����_____ (����)
(3)ʵ���ҳ���Ũ������Ҵ���ϼ�����ȡ��ϩ��
��ʵ��������ϩ�Ļ�ѧ����ʽΪ_____��
�ڹ��ڸ�ʵ���˵������ȷ����_____
a��Ũ����ֻ�д���������
b�����������ſ������ռ���ϩ
c���ڷ�Ӧ�����з��뼸Ƭ���Ƭ��ֹ���Һ����
d���¶ȼ�Ӧ���뷴Ӧ��ҺҺ���£��Ա�����¶�
(3)ʵ������Ƶõ���ϩ�����г������������� SO2��CO2�����˻������ֱ��ͨ����ˮ�У��� �۲쵽��ˮ��ɫ���ܷ�֤����ϩ�����˼ӳɷ�Ӧ��_____(����������������)��ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ 63%��Ũ HNO3 �����ܶ�Ϊ 1.4 g��mL -1������ 240 mL 0.50 mol��L-1 ϡ HNO3����ʵ�������У�
A.10 mL ��Ͳ B.50 mL ��Ͳ C.������ƽ D.������ E.100 mL ����ƿ F.250 mL ����ƿ G.500 mL ����ƿ H.��ͷ�ι� I.200mL �ձ�
��1����Ũ��������ʵ���Ũ��Ϊ_____mol��L -1��
��2��Ӧ��ȡ 63%��Ũ����_____mL��Ӧѡ��_____������������ĸ��ţ���
��3��ʵ��ʱ����ѡ�õ������� D��I��______������ţ���
��4�����ƹ����У����в�����ʹ���Ƶ�ϡ������ҺŨ��ƫ�ߵ��ǣ�����ţ�______��
����ȡŨ�������Ͳ������ˮϴ�� 2~3 �Σ�����ϴ��Һת������ƿ
������ƿʹ��ʱδ����
���ܽ��δ����ȴ����Һ
������ʱ��С������������ˮ�ε�ƿ��
�����ݺ���ҡ�ȡ����ã�����Һ����ڿ̶��ߣ��ټ�����ˮ�����̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᴿ�ǻ�ѧʵ���е���Ҫ���֣������й��ˡ���������ȡ������ȣ�Ӧ�ù㷺����������ˮ�Ǻϳɻ���ϩ�ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ����ͼ��
![]()
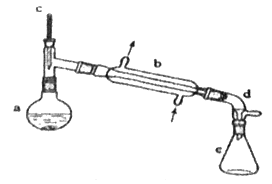
�����õ����й��������£�
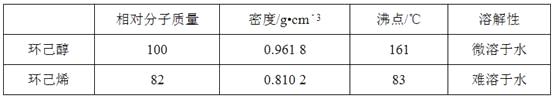
�ϳɷ�Ӧ��
��a�м���20 g��������2СƬ���Ƭ����ȴ��������������1 mLŨ���ᣬb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90 �档
�����ᴿ��
��Ӧ�ֲ��ﵹ���Һ©���зֱ�������5 %̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ10 g��
�ش��������⣺
��1��װ��b��������__��
��2���������Ƭ��������__���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������__������ĸ����
A���������� B����ȴ�� C�����貹�� D����������
��3����Һ©����ʹ��ǰ����ϴ�ɾ���__���ڱ�ʵ���������У�����Ӧ�ôӷ�Һ©����__����Ͽڵ��������¿ڵ���������
��4�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ����__��
��5���ڻ���ϩ�ֲ�����������У��������õ���������__������ȷ�𰸱�ţ���
A��������ƿ B���¶ȼ� C����Һ©�� D��ţ�ǹ� E����ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����K2Cr2O7��Һ����FeSO4��Һ��Ӧ����Fe3����Cr3�����ֽ������ữ��K2Cr2O7��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3�������ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ������˵���в���ȷ����
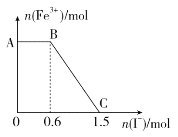
A. ͼ��AB�ε�������ΪK2Cr2O7
B. ��ʼ�����K2Cr2O7Ϊ0.25 mol
C. K2Cr2O7��FeSO4��Ӧ�����ʵ���֮��Ϊ1��3
D. ͼ��BC�η����ķ�ӦΪ2Fe3����2I��===2Fe2����I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D�����ֳ������嵥�ʡ�E����Է���������FС16����FΪ����ɫ���йص�ת����ϵ��ͼ��ʾ(��Ӧ�����벿�ַ�Ӧ����������ȥ)��
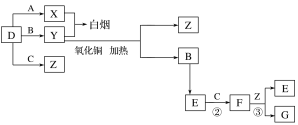
��ش��������⣺
��1��D�Ļ�ѧʽΪ__��Y�Ļ�ѧʽΪ__��E�Ļ�ѧʽΪ__��
��2��Y������ͭ��Ӧ��ÿ����1molB����3mol����ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
��3��Y��E��һ�������¿ɷ�Ӧ����B��Z������һ������ʵ������ķ�Ӧ��������E�Ի�������Ⱦ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
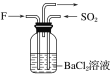
��4������F������SO2��ͨ��������ͬʱͨ��ʢ��BaCl2��Һ��ϴ��ƿ��(��ͼ��ʾ)��ϴ��ƿ���Ƿ��г������ɣ�__��������__��
���𰸡�H2 NH3 NO 2NH3��3CuO![]() N2��3Cu��3H2O 6NO��4NH3
N2��3Cu��3H2O 6NO��4NH3![]() 5N2��6H2O �� ����������ˮ��Ӧ�������ᣬ����ɽ�������������������������ᣬ�������Ȼ�����Ӧ���������ᱵ����
5N2��6H2O �� ����������ˮ��Ӧ�������ᣬ����ɽ�������������������������ᣬ�������Ȼ�����Ӧ���������ᱵ����
��������
A��B��C��D�����ֳ������嵥�ʣ�E����Է�������F��С16����FΪ����ɫ������֪FΪNO2��EΪNO��CΪO2��BΪN2�����ת����ϵ�����嵥��D��A��Ӧ�õ�X�����嵥��D��B��Ӧ�õ�Y��X��Y��Ӧð���̣�Ӧ�ǰ�����HCl��Ӧ������֪DΪ������AΪ������XΪHCl��YΪ������D��C��Ӧ����ZΪˮ��F��Z��Ӧ����GΪHNO3���ݴ˽��
A��B��C��D�����ֳ������嵥�ʣ�E����Է�������F��С16����FΪ����ɫ������֪FΪNO2��EΪNO��CΪO2��BΪN2�����ת����ϵ�����嵥��D��A��Ӧ�õ�X�����嵥��D��B��Ӧ�õ�Y��X��Y��Ӧð���̣�Ӧ�ǰ�����HCl��Ӧ������֪DΪ������AΪ������XΪHCl��YΪ������D��C��Ӧ����ZΪˮ��F��Z��Ӧ����GΪHNO3��
(1)������������֪��D�Ļ�ѧʽΪH2��Y�Ļ�ѧʽΪNH3��E�Ļ�ѧʽΪNO��
(2)NH3������ͭ��Ӧ��ÿ����1molN2����3mol����ͭ����ԭ������CuӦ�ǻ��ϼ�Ϊa����3(2-a)=2��3�����a=0��������Cu���÷�Ӧ�Ļ�ѧ����ʽΪ��2NH3+3CuO ![]() N2+3Cu+3H2O��
N2+3Cu+3H2O��
(3)Y��E��һ�������¿ɷ�Ӧ����B��Z������һ������ʵ������ķ�Ӧ��������E�Ի�������Ⱦ���÷�Ӧ�Ļ�ѧ����ʽΪ4NH3+6NO ![]() 5N2+6H2O��
5N2+6H2O��
(4)����������ˮ��Ӧ�������ᣬ����ɽ�������������������������ᣬ�������Ȼ�����Ӧ���������ᱵ������������NO2������SO2��ͨ��������ͬʱͨ��ʢ��BaCl2��Һ��ϴ��ƿ�У�ϴƿ���г������ɡ�
�����͡��ƶ���
��������
20
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ�������ȡһϵ���������൪�ʣ�������李�����صȣ�Ҳ������ȡ��������ըҩ�ȡ��Իش��������⣺
��1��ijͬѧ������ϡ����ķ�Ӧ����̽������HNO3ֻ����ԭ��NO����
��д���������ϡ���ᷴӦ�����ӷ���ʽ��__��
��д����������ϡ���ᷴӦ�����ӷ���ʽ��__��
����28g���뺬1.6mol�����ϡ����ǡ����ȫ��Ӧ�������ɵ�Fe3����Fe2�������ʵ���֮��Ϊ__��������Ӧ��������Ӧ�����Һ�м���������������Һ��������ϴ�Ӻ��ڿ������������������䣬���յõ��Ĺ�������Ϊ__g��
��2������ˮ��NO3-�����ཡ�������Σ����Ϊ�˽�������ˮ��NO3-��Ũ�ȣ�ij����ˮ�о���Ա��������ڼ��������������۽�NO3-��ԭΪN2��
����ƽ����ʽ��__Al��__NO3-��__OH����__=__[Al(OH)4]����__N2����
��������Ӧ�У���ԭ���뻹ԭ��������ʵ���֮����__����Ӧ��ת�Ƶ���0.3mol������__mL(��״����)N2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�һ������������з�����Ӧ��A(s)��3B(g)![]() 2C(g)��2D(g)��������������˵���÷�Ӧ�ﵽƽ�����
2C(g)��2D(g)��������������˵���÷�Ӧ�ﵽƽ�����
��A�������������仯 ����λʱ��������a mol A��ͬʱ����2a mol C
�������е�ѹǿ���ٱ仯 �����������ܶȲ��ٱ仯
��n(A)��n(B)��n(C)��n(D)��1��3��2��2 ��B��Ũ�Ȳ���
A. �ڢۢݢ� B. �٢ۢܢ� C. �ڢܢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������Ͳ��ȡ50mL0.25mol/L���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50mL0.55mol/LNaOH��Һ��������һ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ�������Һ����¶ȡ�
�ش��������⣺

��1��д��ϡ�����ϡ����������Һ��Ӧ��ʾ�к��ȵ��Ȼ�ѧ����ʽ(�к�����ֵΪ57.3kJ/mol)�� ______��
��2��ѧ������ϡ������ϡ�ռ���Һ�ⶨ�к���װ����ͼ��
��ʵ��ʱ����Ҫ�IJ����������ձ�����Ͳ���Ҫ��____��
�ڸ�װ������һ�������ǣ�_____��
��3������ͬŨ�Ⱥ�����İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��____(����ƫ��������ƫС��������Ӱ����)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com