
| A. | 酸式盐的溶液一定显碱性 | |
| B. | 只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液是中性的 | |
| C. | 纯水呈中性时因为水中c(H+)=c(OHˉ) | |
| D. | 碳酸溶液中氢离子的物质的量浓度是碳酸根离子物质的量浓度的2倍 |
分析 A.弱酸的酸式盐存在电离和水解,溶液酸碱性取决于电离程度和水解程度大小;
B.酸碱强弱不同,元数不同酸碱性不同;
C.中性溶液中氢离子的浓度等于氢氧根离子的浓度;
D.碳酸是弱酸,在溶液中只能部分电离.
解答 解:A.弱酸的酸式盐存在电离和水解,溶液酸碱性取决于电离程度和水解程度大小,若NaHSO3溶液呈酸性,NaHCO3溶液呈碱性,故A错误;
B.酸碱强弱不同,元数不同酸碱性不同,如醋酸和氢氧化钠反应生成醋酸钠溶液显碱性,故B错误;
C.中性溶液中氢离子的浓度等于氢氧根离子的浓度,所以纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等,故C正确;
D.碳酸是弱酸部分电离,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,且主要以第一步电离为主,则氢离子浓度大于碳酸根离子浓度的2倍,故D错误;
故选C.
点评 本题考查了盐类水解和弱酸的电离的分析判断、溶液酸碱性的理解应用,题目难度不大,注意溶液酸碱性取决于氢离子、氢氧根离子浓度大小,不能直接用pH判断,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
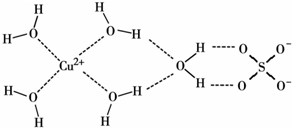
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:15 | B. | 1:1:13 | C. | 1:2:13 | D. | 2:13:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO-CH2-CH2-CHO | B. | HOOC-COOH | C. | HO-CH2-CH2-COOH | D. | CH3-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
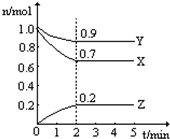 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、P、O | B. | Li、Be、Mg | C. | C、N、P | D. | O、C、F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com