
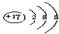
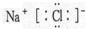
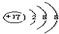 ,故B正确;
,故B正确;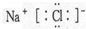 ,故C正确;
,故C正确;

 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
海水中富含氯元素。
(1)KCl广泛应用于医药和农业,KCl晶体中基态的氯离子电子排布式为
(2)下列是部分金属元素的电离能
| X | Y | Z | |
| 第一电离能(KJ/mol) | 520.2 | 495.8 | 418.8 |
已知X Y Z 的价层电子构型为nS1,则三种金属的氯化物(RCl)的熔点由高到低的顺序为
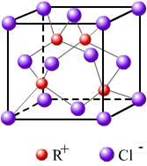
(3)RCl用作有机机合成催化剂, 并用于颜料, 防腐等工业。R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图所示。R的元素符号是 ,与同一个Cl-相连的 R+有 个。
(4) 卤代烃在有机合成中作用巨大,烃基的结构对卤代烃的活性有很大的影响。CH3—CH2—Cl和碱溶液容易发生取代反应,而CH2=CH2—Cl 和碱溶液不起作用,请从结构上解释其差异
(5) HCl和 HF结构相似,由于氢键的存在使两者性质上存在较大差异,请列举出由于氢键的影响导致的性质差异
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题
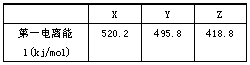
查看答案和解析>>
科目:高中化学 来源:2011年江苏省淮安中学高考化学模拟试卷(解析版) 题型:选择题
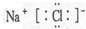
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com