
【题目】滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和 ![]() 如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×1017 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的
A.KIB.![]() C.KBrD.
C.KBrD.![]()
【答案】B
【解析】
A.氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银![]() 溴化银
溴化银![]() 碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银;所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故A错误;
碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银;所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故A错误;
B.铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,,![]() ,
, ![]() ,
,![]() ,
,![]() ;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入
;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入![]() 作指示剂可以正确的测定氯化物的含量,故B 正确;
作指示剂可以正确的测定氯化物的含量,故B 正确;
C.依据A分析可知碘化银优先于氯化银析出,不能测定氯化物的含量,故C错误;
D.硫化银的Ksp很小,![]() ,计算得到需要的银离子浓度
,计算得到需要的银离子浓度![]() ,
,![]() ,
,![]() ,通过计算得出硫化银也比氯化银先沉淀.故D错误;
,通过计算得出硫化银也比氯化银先沉淀.故D错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列有关说法正确的是(混合后溶液体积变化忽略不计)
A. 将pH=2的盐酸和pH=5的稀硫酸等体积混合,混合液的pH=3.5
B. 将pH=11的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,混合液的pH=12
C. 将pH=2的H2X溶液稀释至原来的1 000倍,得到混合溶液的pH=5
D. 将pH=1的盐酸和0.1 mol·L-1 的Ba(OH)2溶液等体积混合,混合液的pH=12.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据短周期元素的信息回答问题。
元素信息 | |
A | 第3周期第ⅥA族 |
B | 族序数是周期数的3倍 |
C | 原子序数是11 |
D | D3+与Ne电子数相同 |
(1)写出A、B的元素符号____________、_________,C、D的元素的名称__________、_____________。
(2)写出B、C单质在加热时反应的方程式____________________________________
(3)从原子结构角度分析A与B的______________相同,C与D的_______________相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组通过测量溶液的电导率(电导率越大,说明溶液的导电能力越强)探究沉淀溶解平衡,各物质的电导率数据如下:
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
物质 |
固体 |
|
饱和溶液 |
饱和溶液 |
NaCl溶液 |
|
饱和溶液 |
电导率 | 0 | 7 | 37 | 389 | 1989 | 1138 | 13 |
下列分析不正确的是
A. ![]() 固体中不存在自由移动的离子
固体中不存在自由移动的离子
B. 与①、②对比,可说明③中![]() 发生了电离
发生了电离
C. ⑤、⑥等体积混合后过滤,推测滤液的电导率一定大于13
D. 将①中固体加入④中,发生反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断正误(在答题卡表格中①~题题号对应位置画“√”或“×”)。
(1)2020年6月23日9时43分北斗系统第五十五颗导航卫星暨北斗三号最后一颗全球组网卫星成功发射!执行本次发射任务的长三乙运载火箭加装的常规燃料为偏二甲肼(C2H8N2)和四氧化二氮。偏二甲肼和四氧化二氮也可以作为燃料电池的两极反应物。二者反应的产物均对环境不产生污染。根据以上信息判断下列说法正误:
①偏二甲肼是有机物,其中氮元素化合价为-3_____
②生成1molCO2转移8mol电子_____
③偏二甲肼与四氧化二氮的反应是放热反应_____
④该燃料电池中偏二甲肼是负极反应物_____
(2)如图所示装置,用生成的氯气与乙二醛制备乙二酸,反应原理为![]() +2Cl2+2H2O→
+2Cl2+2H2O→![]() +4HCl。
+4HCl。
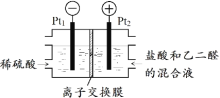
判断以下说法的正误:
⑤该装置利用上述反应将电能全部转化为化学能_____
⑥Pt1电极的反应式为2H2O+2e-=H2↑+2OH-_____
⑦盐酸除增强溶液导电性的作用,还提供Cl-参与电极反应_____
⑧理论上每得到0.1mol乙二酸,将有0.4molH+从右室迁移到左室_____
(3)判断对下列图像的描述的正误:
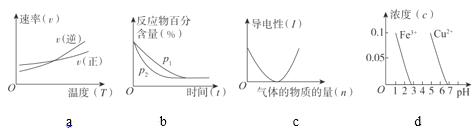
⑨根据图a可判断反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0_____
2AB3(g)的ΔH>0_____
⑩图b可表示压强(P)对反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响_____
3C(g)+D(s)的影响_____
图c可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化_____
根据图d,除去CuSO4溶液中的Fe3+,可加入NaOH调节pH至3~4_____
(4)利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
实验装置 | 实验编号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
| i | H2O | 7 |
|
ii | 1.0mol·L-1NH4Cl | 5 | ||
iii | 0.5mol·L11(NHspan>4)2SO4 | 5 | ||
iv | 1.0mol·L-1NaCl | 7 | ||
v | 0.5mol·L-1Na2SO4 | 7 |
通过以上实验判断下列说法正误:
i与iv、v比较说明盐溶液可以加快吸氧腐蚀速率_____
ii与iii、iv与v比较说明吸氧腐蚀速率与阴离子种类无关_____
向实验v溶液中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快_____
向实验ii溶液中加等体积的0.5mol·L-1(NH4)2SO4,吸氧腐蚀速率一定加快_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.00 mol·L-1NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。

下列说法正确的是
A.室温时,HA的电离度约为10-6
B.图中B点时,溶液的Kw略大于1×10-14
C.图中C点时,溶液中c(A-)=c(Na+)>c(H+)=c(OH-)
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应。请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
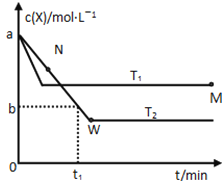
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种胃药中抗酸剂为CaCO3。甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应)。请回答下列有关问题:
(1)甲同学拟用下图装置测量样品与足量稀盐酸反应生成CO2的体积,来分析CaCO3的含量。则
①X的作用是__________。
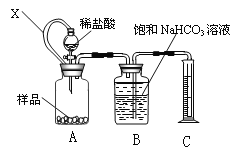
②B中不可改用饱和Na2CO3溶液,用离子方程式说明理由_______。
(2)乙同学拟用以下操作测定样品中CaCO3含量:A.配制0.100 mol/L HCl溶液和0.100 mol/L NaOH溶液,B.取一粒药片(0.100 g),研碎后加入20 mL蒸馏水,C.加入30 mL 0.100 mol/L 的盐酸,充分反应,D.用0.100 mol/L NaOH溶液中和过量的盐酸至中性,共消耗NaOH溶液18.00 mL,该胃药中CaCO3的质量分数是____写出计算过程)。
(3)甲同学将实验中获得的17.92 mL CO2 (标准状况)通入10 mL 0.100 mol/L NaOH溶液中,判断所得溶液的溶质是_____(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com