
【题目】某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A. 前2 min,D的平均反应速率为0.2 mol·L-1·min-1 B. 此时,B的平衡转化率是40%
C. 升高该体系的温度,化学平衡常数不变 D. 增加C,逆向速率增大
科目:高中化学 来源: 题型:
【题目】现有25mL 2molL﹣1 Na2CO3和75mL 1molL﹣1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况是( )
A.均为0.84 L
B.均为0.56 L
C.①>②
D.②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)将1 mol SO2和0.5 mol O2充入一密闭容器,发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g),混合体系中SO3的平衡百分含量和温度的关系如图1所示。
2SO3(g),混合体系中SO3的平衡百分含量和温度的关系如图1所示。

①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_____(填“向左”、“向右”或“不”)移动。
②若在恒温、体积不变的容器中向上述平衡体系中通入SO3气体,平衡_______填“向左”、“向右”或“不”)移动,再次平衡后SO3的百分含量_______ (填“增大”、“不变”或“减小”)
③若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
③该反应化学平衡常数的表达式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体),下列分析或结果错误的是

A. 原混合酸中HNO3的物质的量为0.1 mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+ == 3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的沸点:甲烷:﹣162℃;乙烷:﹣89℃;丁烷:﹣1℃;戊烷:36℃.根据以上数据推断丙烷的沸点可能是( )
A.约﹣40℃
B.低于﹣162℃
C.低于﹣89℃
D.高于36℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( ) 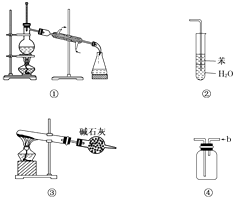
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收氨气,能够防止倒吸
C.以NH4HCO3为原料,装置③可用于制备少量CO2
D.装置④a口进气可收集Cl2、NO2等气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com