
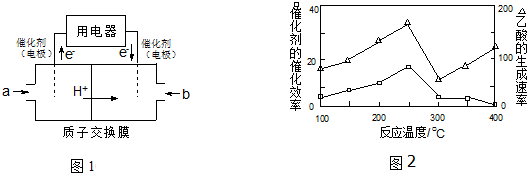
分析 (1)计算1mol甲烷完全放热放出的热量,反应放热△H<0;
(2)由图可知,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极,通入b为氧气,获得电子,酸性条件下生成水;
(3)①根据乙酸反应速率最大、催化活性最高选择;
②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,配平书写离子方程式;
(4)根据电子转移守恒计算.
解答 解:(1)1mol甲烷完全放热放出的热量为444.8kJ×$\frac{1mol×16g/mol}{8g}$=889.6kJ,故△H=-889.6kJ/mol,故答案为:-889.6;
(2)由图可知,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极,通入b为氧气,获得电子,酸性条件下生成水,正极电极反应式为:O2+4e-+4 H+=2H2O,故答案为:负极;O2+4e-+4 H+=2H2O;
(3)①250℃时乙酸反应速率最大、催化活性,故选择250℃,故答案为:250℃;
②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,反应离子方程式为:3 CuAlO2+16 H++NO3-=NO↑+3 Al3++3Cu2++8H2O,故答案为:3 CuAlO2+16 H++NO3-=NO↑+3 Al3++3Cu2++8H2O;
(4)根据电子转移守恒,则:8.96L×[4-(-4)]=22.4L×2x,解得x=1.6,故答案为:1.6.
点评 本题属于拼合型题目,涉及反应热计算、原电池、反应条件控制、离子方程式书写、氧化还原反应计算等,是对学生综合能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素可显+6价 | |
| B. | X、Y、Z三种元素组成的化合物化学式可能是X2YZ3、X2YZ4等 | |
| C. | X、Y、Z三种元素组成的化合物不一定呈中性 | |
| D. | Y的电负性比Z大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都是常用调味品的主要成分 | B. | 都能使紫色石蕊溶液褪色 | ||
| C. | 都能和CaCO3反应 | D. | 都能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
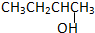 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③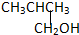 ④
④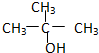
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com