
A.加入浓硫酸和铜屑后共热
B.加热浓缩后,与浓硫酸、铜屑共热
C.加热蒸干后,再加铅屑和浓硫酸
D.加热蒸干后,混入炭粉并点燃
科目:高中化学 来源: 题型:
| A、制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 | B、检验某溶液中是否含SO42-,应先加入BaCl2溶液,再加入稀硝酸 | C、滴定管洗净后应先用蒸馏水润洗,然后再注入标准液进行滴定 | D、在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(辽宁实验中学2008届高三上学期期末测试,化学,2)下列叙述正确的是
A.检验某稀溶液中是否含有NO3-,可加入浓H2SO4和铜片,观察有无红棕色气体产生
B.鉴别NO2和溴蒸气可用AgNO3溶液,而不能用淀粉KI溶液
C.和H3PO4溶液中加入AgNO3溶液,观察有黄色沉淀生成,证明和PO3—4存在
D.检验溶液中是否含NH4+,可加入足量NaOH溶液,加热,再用红色湿润的石蕊试纸伸入试管内检验是否变蓝
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高一上学期期末考试化学试卷 题型:选择题
对下列实验过程的评价,正确的是
A.某固体加入稀盐酸,产生无色且使澄清石灰水变浑浊的气体,证明该固体一定含CO32-
B. 检验烧碱溶液中是否含Cl-,先加稀盐酸,再加AgNO3溶液,产生白色沉淀
C. 某溶液中滴加BaCl2溶液,再加稀HNO3,产生白色沉淀,原溶液中一定含SO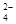
D. 某溶液中滴入KSCN溶液无明显变化,再加入氯水呈红色,原溶液中一定含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(Ⅰ)(2分)下列操作会导致实验结果偏高的是
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线。
B.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度
C.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
D.10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
(Ⅱ)(2分)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B. 配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
(Ⅲ)、离子反应是中学化学中重要的反应类型,回答下列问题:
(1)(2分)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)(6分)一种无色透明溶液中,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2试液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是 ;肯定存在的离子是 ;不能作出判断的离子是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com