
| A. | 放电过程中电解质溶液中阴离子移向正极 | |
| B. | 放电时每转移0.5mol电子,负极有0.5molV2+被氧化 | |
| C. | 充电时阳极附近溶液的酸性减弱 | |
| D. | 充电时阳极反应式为:VO2++2H++e-═VO2++H2O |
分析 根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理进行分析:
A、电解质溶液中阳离子向正极移动,阴离子向负极移动;
B、放电时氧化剂为VO2+离子,在正极上被还原后生成VO2+离子,根据化合价判断转移的电子数;
C、充电时阳极上发生失电子的氧化反应,根据电极反应式进行回答;
D、充电时阳极上发生失电子的氧化反应.
解答 解:电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应.
A、电解质溶液中阳离子向正极移动,阴离子向负极移动,故A错误;
B、放电时氧化剂为VO2+离子,在正极上被还原后生成VO2+离子,每转移2mol电子时,消耗2mol氧化剂,转移0.5mol电子,负极有0.5molV2+被氧化,故B正确;
C、充电时阳极发生反应:H2O+VO2+-e-=VO2++2H+,生成氢离子,所以溶液的酸性增强,故C错误;
D、充电时阳极上发生失电子的氧化反应,即H2O+VO2+-e-=VO2++2H+,故D错误.
故选B.
点评 本题考查原电池的工作原理,题目难度不大,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ/mol) | 414 | 489 | 565 | 155[ |
| A. | -1940kJ•mol-1 | B. | +1940kJ•mol-1 | C. | -485kJ•mol-1 | D. | +485kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H3>△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题.甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=-105kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题.甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=-105kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为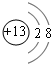 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量的气体,其气体摩尔体积也相同 | |
| B. | 气体摩尔体积是指1mol任何气体所占的体积为22.4L | |
| C. | 标准状况下的气体摩尔体积约为22.4L/mol | |
| D. | 一定物质的量的气体所占的体积就是气体摩尔体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com