
| A�� | �������Ȼ�����Ŀ���Ǽ�����Һ��ɫ���Ŵ�ʵ������ | |
| B�� | ����ʵ���Ŀ�����о�Ũ�ȶ�˫��ˮ�ֽ����ʵ�Ӱ�� | |
| C�� | ����ʵ�������A��B�Թܶ������ԣ����Խ��Ǹ��ܲ����Ե��Թܷ�����ˮԡ�����۲� | |
| D�� | ��С���հ�AҩƷ���ã����������ȥ�ˣ��ڶ���������ʵ�������бȽ� |
���� ���������ڴ��������¿ɷֽ�����������ˮ����Ӧ���Ȼ���Ϊ��Ӧ�Ĵ��������ȿ�����Ӧ���ʣ��Դ˽����⣮
��� �⣺A���Ȼ���Ϊ��Ӧ�Ĵ�����������Ӧ���ʣ���A����
B��������ͬ��Ũ�Ȳ�ͬ����Ӧ���ʲ�ͬ����B��ȷ��
C���Ȼ����������£���������ֽ��������������������ɣ��������ԣ���C����
D��ʱ��ϳ���������������ʣ��������ʵ�飬��D����
��ѡB��
���� ���⿼�黯ѧʵ�鷽�������ۣ�Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬ע�����ʵ���ԭ���Լ�Ӱ�컯ѧ��Ӧ���ʵ����أ��ѶȲ���


 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
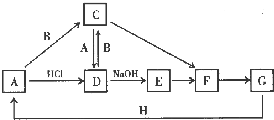 A��H ����ѧ��ѧ�г��������ʣ�ת����ϵ����ͼ��ʾ�����ַ�Ӧ���Ӧ�����Ͳ�������ȥ����A��H �dz����Ľ������ʣ���ҵ�ϳ��õ�ⷨұ��H��ͨ��״����B Ϊ����ɫ���壻G Ϊ����ɫ���壻C��D��E��F��G ���ֻ����ﺬ��ͬһ��Ԫ�أ�
A��H ����ѧ��ѧ�г��������ʣ�ת����ϵ����ͼ��ʾ�����ַ�Ӧ���Ӧ�����Ͳ�������ȥ����A��H �dz����Ľ������ʣ���ҵ�ϳ��õ�ⷨұ��H��ͨ��״����B Ϊ����ɫ���壻G Ϊ����ɫ���壻C��D��E��F��G ���ֻ����ﺬ��ͬһ��Ԫ�أ� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ṳ���ĸ�ͬ���칹�壨�������Ұ��������ᣩ | |
| B�� | ��ͬ�����µķе㣺�Ҷ������Ҵ������飾���� | |
| C�� | CH3COOCH3�ں˴Ź��������������ֲ�ͬ���͵���ԭ�� | |
| D�� | ���ֲ�ͬ�İ����������۷�Ӧʱ�����ɲ�����4�ֵľۺ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��A�ľ����������Ӿ��壮
��A�ľ����������Ӿ��壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮ��Ӧ Na+H2O�TNa++OH-+H2�� | |
| B�� | ̼������ϡ���ᷴӦCO32-+2H+�TCO2��+H2O | |
| C�� | ������ͭ��ϡ���ᷴӦOH-+H+�TH2O | |
| D�� | �������ᷴӦ2Fe+6H+�T2Fe3++3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+Ba2+ SO42- OH- | B�� | Ag+ NO3? Cl?K+ | ||
| C�� | H+ NO3-Fe2+ K+ | D�� | Cu2+NH4+OH- SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1132 kJ | B�� | 283kJ | C�� | 442 kJ | D�� | 990.5kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com