

 2NH3(l) △H=" -2(b+c-a)" kJ/mol(2)(0.5Q2+1.5Q1-Q3)
2NH3(l) △H=" -2(b+c-a)" kJ/mol(2)(0.5Q2+1.5Q1-Q3) 2NH3(l) △H=" -2(b+c-a)" kJ/mol。(2)②-③+3×①整理可得C2H5OH(g)+ 3O2(g)=2CO2(g)+3H2O(l) △H=-(Q2+3Q1-Q3) kJ/mol。1mol的乙醇质量为46g.所以23 g液体酒精即0.5mol完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q2+1.5Q1-Q3)KJ.
2NH3(l) △H=" -2(b+c-a)" kJ/mol。(2)②-③+3×①整理可得C2H5OH(g)+ 3O2(g)=2CO2(g)+3H2O(l) △H=-(Q2+3Q1-Q3) kJ/mol。1mol的乙醇质量为46g.所以23 g液体酒精即0.5mol完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q2+1.5Q1-Q3)KJ.

科目:高中化学 来源:不详 题型:问答题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2(g)+ N2(g) △H<0,
2CO2(g)+ N2(g) △H<0,
 N2O4(g) ΔH=-56.9 kJ/mol ②
N2O4(g) ΔH=-56.9 kJ/mol ② 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。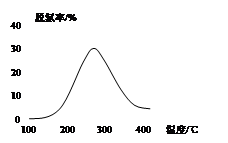

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的O2比O3能量低,由O2变O3为放热反应 |
| B.等质量的O2比O3能量低,由O2变O3 为吸热反应 |
| C.3O2(g)=2O3 (g)△H=285.0 kJ/mol |
| D.O3比O2稳定,由O2变O3 为吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Cl2+2H2O,
2Cl2+2H2O, 
| A.16kJ | B.24kJ | C.32kJ | D.48kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是| A.Q1=Q3=197kJ | B.Q1=Q3<197kJ |
| C.Q1=2Q2 <197kJ | D.Q2<Q1<197kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④⑤ | B.①②④ | C.①②⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲烷的燃烧热为 890 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890 kJ·mol-1 |
B.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH=-38.6 kJ·mol-1 2NH3(g);ΔH=-38.6 kJ·mol-1 |
| C.已知:H2(g)+F2(g)=2HF(g);ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用滴定管取所用药品 |
| B.NaOH溶液在倒入小烧杯时,有少量溅出 |
| C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多 |
| D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com