
【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____________。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
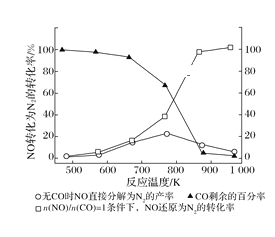
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为______,在![]() =1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
=1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
活性炭 | NO | E | F | |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①若T1<T2,则该反应的△H _________ 0(填“>”“<”或“=”)。
②上述反应T1℃时达到化学平衡后再通入0.10molNO气体,则达到新化学平衡时NO的总转化率为_____________。
【答案】D NO的分解为放热反应,升高温度不利于反应正向进行 870K(850-900K之间均可) < 80%
【解析】
(1)汽缸中生成NO的反应N2(g)+O2(g)2NO(g)—Q,该反应为气体分子数不变的放热反应。
(2)升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,反应为放热反应。
(3)从表中数据可知,碳、NO、E和F的化学计量数之比为(3.000-2.960):(0.10-0.020):0.04:0.04=1:2:1:1,得到反应方程式C+2NO![]() N2+CO2。
N2+CO2。
(1)当可逆反应的正逆反应速率相等,各组分浓度不再改变时反应达到平衡状态。
A.气体的总质量、容器的体积一直不变,则混合气体的密度一直不变,不能说明达到平衡状态,A错误;
B.反应前后气体的分子数不变,混合气体的压强一直无变化,不能说明达到平衡状态,B错误;
C.N2、O2、NO的物质的量之比为1∶1∶2,不能说明正逆反应速率相等,各组分浓度不再改变,C错误;
D.氧气的转化率不再变化,说明各组分的浓度不再改变,能说明反应达到平衡状态,D正确;
答案选D。
(2)升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,该反应放热;由图可知,在![]() =1的条件下,870K (850-900K之间均可)时,NO还原为N2的转化率接近为100%,则为更好的除去NOx,应控制的最佳温度在870K(850-900K之间均可)左右。
=1的条件下,870K (850-900K之间均可)时,NO还原为N2的转化率接近为100%,则为更好的除去NOx,应控制的最佳温度在870K(850-900K之间均可)左右。
(3)①T1 温度下平衡时生成物的物质的量大于T2温度下的,因为T1<T2,说明升高温度平衡逆向移动,反应为放热反应,则该反应的△H<0。
②反应C+2NO![]() N2+CO2是一个气体体积不变的反应,而气态反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为
N2+CO2是一个气体体积不变的反应,而气态反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为![]() ,则达到新平衡时NO的转化率为80%。
,则达到新平衡时NO的转化率为80%。


科目:高中化学 来源: 题型:
【题目】某同学将一小块金属钠置于表面皿上,并露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白
变白![]() 表面出现液滴
表面出现液滴![]() 白色固体
白色固体![]() 白色粉末,下列说法正确的是( )
白色粉末,下列说法正确的是( )
A.过程①钠转化为过氧化钠
B.过程③是碳酸钠吸收空气中的水蒸气形成溶液
C.过程④只发生了物理变化
D.如果时间足够长,最后得到的白色粉末是Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
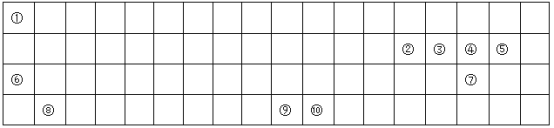
请回答下列问题:
(1)在表中画出元素周期表前四周期的边框______。
(2)表中属于d区的元素符号为________,其基态原子的价层电子排布图为__________。
(3)元素①与②形成的一种化合物是重要的化工原料,常把该物质的产量作为衡量石油化工发展水平的标志。有关该分子的说法正确的是_____ 。
A.分子间存在氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该分子中,中心原子采用sp2杂化
(4)①、③、④、⑦、⑩五种元素形成的一种常见的深蓝色配合物, 其化学式为_____________
1摩尔配合离子所含σ键个数为__________,配体分子的空间构型为_______ ;与该配体分子互为等电子体的阳离子的符号为___________。
(5)③、④、⑥三种元素第二电离能从小到大依次为:___________(用元素符号填空)。
(6)元素⑩的焰色为绿色,很多金属元素能形成焰色反应的原因为_________________。
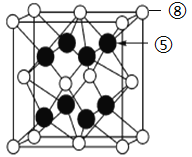
(7) ⑧与⑤形成离子化合物的晶胞结构如图所示。可以用____________方法区分晶体和非晶体。该晶胞中,⑧离子的配位数为_____________;若晶体的密度为ag·cm-3,阿伏加德罗常数的值为NA,则晶胞中最近的两个⑤离子间距离为_________________pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2X(g)+Y(g)![]() 2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
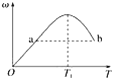
A. T1时,v正>v逆
B. 正反应的ΔH<0
C. a、b两点的反应速率v(a)=v(b)
D. 当温度低于T1时,ω增大的原因是平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,中科院大连化物所化学研究团队在化学链合成NH,研究方面取得新进展,使用的催化剂有![]() 、
、![]() 、Fe、
、Fe、![]() 、MgO等,相关研究成果发表于《自然一能源》上。
、MgO等,相关研究成果发表于《自然一能源》上。
请回答下列问题:
(1)基态Fe原子中有___个运动状态不同的电子;基态Fe原子价电子的排布图为___,最高能层电子的电子云轮廊图形状为____。
(2)Ba元素在周期表中的分区位置是____区,元素的第一电离能:Mg_______Al(填“>”或“<”),H、N、O元素的电负性由大到小的顺序为_____(用元素符号表示)。
(3)![]() 分子的空间构型为____,其中心原子的杂化方式为_____,与
分子的空间构型为____,其中心原子的杂化方式为_____,与![]() 互为等电子体的阳离子是_______(填离子符号,任写一种)。\
互为等电子体的阳离子是_______(填离子符号,任写一种)。\
(4)已知:![]() 的熔点为770℃,
的熔点为770℃,![]() 的熔点为1275℃,二者的晶体类型均为___,
的熔点为1275℃,二者的晶体类型均为___,![]() 的熔点低于
的熔点低于![]() 的原因是___。
的原因是___。
(5)研究发现,只含Ni、Mg和C三种元素的晶体具有超导性,该物质形成的晶体的立方晶胞结构如图所示:
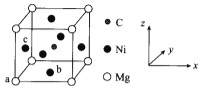
①与Mg紧邻的Ni有_______个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数a为(0,0,0);b为(![]() ,
,![]() ,0)。则c原子的坐标参数为___。
,0)。则c原子的坐标参数为___。
③已知:晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为![]() ,则晶体的密度
,则晶体的密度![]() _____
_____![]() (用含a、
(用含a、![]() 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生实验小组用50mL 1.0mol·L-1的盐酸与50mL 1.1mol·L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定。
(1)图中装置缺少的一种仪器,该仪器名称为_________。
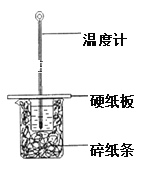
(2)如果改用60mL 1.Omol·L-1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量____________(填“增加” “减少”或“不变”),所求中和热数值 ________ (填“增加”“减少”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
主族 周期 | ⅠA | 0族 | ||||||
一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
二 | ② | |||||||
三 | ③ | ④ | ⑤ | ⑥ | ||||
(1)最活泼的金属元素是_______________(填元素符号)
(2)②和⑤两种元素原子半径较大的是_______________(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的是_____________(填元素符号);
(3)写出①的单质在⑥的单质中燃烧的化学方程式_______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z均为元素周期表中前20号元素,X和Z位于同一周期,Y的阳离子和Z的阴离子的核外电子排布相同,Y2Z2与H2Z或XZ2反应都能生成单质气体Z2。
(1)写出元素名称:X________,Y________,Z________。
(2)写出下列物质的电子式:Y2Z2__________________,XZ2__________________。
(3)用电子式表示Y2Z的形成过程:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com