
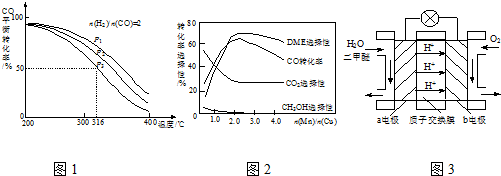
���� ��1���ݸ�˹��������֪���Ȼ�ѧ����ʽ������Ӧ����ֵ���мӼ���������Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ����ֵ���мӼ���
��2�����CH3OCH3���ʣ��ı�����Ӧʹƽ�������ƶ������ƽ���ƶ�ԭ���������
��3����Ӧ������H2O��g�������ڷ�Ӧ�������ƶ���ͬʱ�˷�Ӧ������H2�������ڷ�Ӧ�������ƶ���
��4��A����ͼ��֪��ѹǿһ��ʱ�����¶�����CO��ת���ʼ�С��˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ��
B������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���CO��ת��������
C������������������ƽ�������ƶ���CO��ת��������
��5��CO��ת����������ɶ����ѵ�ѡ�������ʱ��ã�
��6�������ӽ���Ĥ���������ƶ������֪��aΪ������bΪ��������������������Ӧ�������ڸ���ʧȥ�������ɶ�����̼�������ӣ�
��� �⣺��1����֪�ϳɶ����ѵ�������Ӧ���£�
��CO��g��+2H2��g��?CH3OH��g����H1=-90.7kJ•mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g����H2=-23.5kJ•mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g����H3=-41.2kJ•mol-1
�ɸ�˹���ɿ�֪��ͨ���١�2+��+�ۿɵ�����Ӧ����ʽ3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g�������H=2��H1+��H2+��H3=-246.1KJ/mol���ʴ�Ϊ��-241.6��
��2��A������Ӧ���Ũ��ƽ�����ƣ�����ʹ�ù�����CO�������CH3OCH3���ʣ���A��ȷ��
B���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����ƣ���CH3OCH3���ʻή�ͣ���B����
C���÷�Ӧ������Ϊ�����С�ķ�����������ѹǿƽ�����ƣ������CH3OCH3���ʣ���C��ȷ��
�ʴ�Ϊ��AC��
��3����Ӧ������H2O��g�������ڷ�Ӧ�������ƶ���ͬʱ�˷�Ӧ������H2�������ڷ�Ӧ�������ƶ����ʷ�Ӧ�������CH3OCH3�IJ��ʣ�
�ʴ�Ϊ����Ӧ������H2O��g�������ڷ�Ӧ�������ƶ���ͬʱ�˷�Ӧ������H2�������ڷ�Ӧ�������ƶ���
��4��A����ͼ��֪��ѹǿһ��ʱ�����¶�����CO��ת���ʼ�С��˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ���ʡ�H��0����A��ȷ��
B������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���CO��ת������������P1��P2��P3����B����
C������P3��316��ʱ����ʼʱ$\frac{n��{H}_{2}��}{n��CO��}$=3������������������������������Ũ�ȣ�ƽ�����ƣ�CO��ת������������COת���ʴ���50%����C����
�ʴ�Ϊ��A��
��5����ͼ��֪��������$\frac{n��Mn��}{n��Cu��}$ԼΪ2.0ʱ��CO��ת����������ɶ����ѵ���࣬
�ʴ�Ϊ��2.0��
��6�������ӽ���Ĥ���������ƶ������֪��aΪ������bΪ��������������������Ӧ�������ڸ���ʧȥ�������ɶ�����̼�������ӣ�a�缫�ĵ缫��ӦʽΪ��CH3OCH3-12e-+3H2O=2CO2��+12H+��
�ʴ�Ϊ��CH3OCH3-12e-+3H2O=2CO2��+12H+��
���� ���⿼�黯ѧƽ��Ӱ�����ء���ѧƽ���������ѧƽ��ͼ��˹����Ӧ�á�ԭ��صȣ���Ŀ�漰��֪ʶ��϶࣬�ۺ��Խ�ǿ����6����ע�����ʾ��ͼ�ж������������ɣ���Ŀ���еȣ�


 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ȩ���������������ɷ�ȩ��֬�Ľṹ��ʽΪ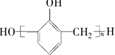 | |
| B�� | ��NH4��2SO4��CuSO4��Һ����ʹ�����ʳ���������������ԭ����ͬ | |
| C�� | �����Ӳ֬�ụΪͬϵ�C6H14��C9H20Ҳһ����Ϊͬϵ�� | |
| D�� | ����ˮ��ʵ�飺������Һ�м���ϡ�������ˮ���ˮ��Һ���ټ���NaOH��Һ���к�Һ�����������Cu��OH��2����Һ���Ⱥ��к�ɫ���������ۣ�������ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ��Cl-��Fe2+ | B�� | �۵�Al2O3��Al | ||
| C�� | �ȶ���Fe��OH��2��Fe��OH��3 | D�� | ����Al��OH��3��NH3•H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu2++2OH-�TCu��OH��2�� CuCO3+2NaOH�TCu��OH��2��+Na2CO3 | |
| B�� | CO32-+2H+�TCO2��+H2O BaCO3+2HCl�TBaCl2+CO2��+H2O | |
| C�� | Ca2++CO32-�TCaCO3�� Ca��NO3��2+Na2CO3�TCaCO3��+2NaNO3 | |
| D�� | H++OH-�TH2O Ba��OH��2+H2SO4�TBaSO4��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ƴ����ú���� | |
| B�� | NaOH��Һʢ���ڴ���Ƥ�����Լ�ƿ�� | |
| C�� | ���Ƶ���ˮ��������ɫ�����Լ�ƿ�� | |
| D�� | Ư��¶���ڿ����б��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�28 g N2�����е�ԭ����ĿΪ2NA | |
| B�� | �����£�22.4 L�� H2������������ΪNA | |
| C�� | ��״���£�1 mol H2O��ռ�����ԼΪ22.4 L | |
| D�� | ���³�ѹ�£�24 g Mg��������������ȫ��Ӧת�Ƶĵ�����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | NaCl | C�� | NaOH | D�� | BaSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
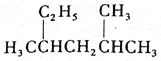 2��4-��������
2��4-��������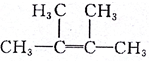 2��3-����-2-��ϩ
2��3-����-2-��ϩ�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com