
| X | ||
| Y | ||
| Z |
| A. | X是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | Y单质的氧化性比Z单质的氧化性弱 |
分析 由短周期元素的位置可知,X为He、Y为F、Z为S.
A.稀有气体化学性质不活泼,不存在氧化物含氧酸;
B.F元素没有最高正化合价;
C.Z为硫元素,其最高正化合价氧化物对应水化物为硫酸;
D.非金属性越强,单质氧化性越强.
解答 解:由短周期元素的位置可知,X为He、Y为F、Z为S.
A.X为He,原子最外层为稳定结构,化学性质不活泼,不存在氧化物含氧酸,故A错误;
B.F元素没有最高正化合价,故B错误;
C.Z为硫元素,其最高正化合价氧化物对应水化物为硫酸,硫酸属于强酸,故C正确;
D.同周期自左而右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,单质氧化性越强,故D错误,
故选C.
点评 本题考查元素周期表与元素周期律,比较基础,需要学生熟练掌握元素周期表的结构,注意元素周期表中一些元素的特殊性.


科目:高中化学 来源: 题型:选择题

| A. | 步骤(2)产物中残留的烯丙醇可用溴水检验 | |
| B. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| C. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| D. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①③④ | B. | ②④ | C. | ①③⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>W | |
| B. | 四种元素一定属于短周期元素 | |
| C. | 最高价氧化物对应水化物的碱性:L>K | |
| D. | 原子序数:L>K>W>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1 451kJ•mol-1 I3=7 733kJ•mol-1 I4=10 540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
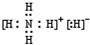 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
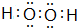 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
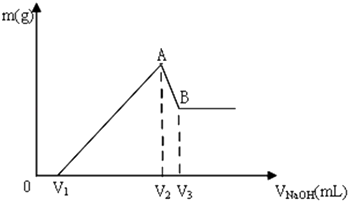
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com