
| A. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{1}$ | B. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{4}{1}$ | C. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{4}$ | D. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{3}{2}$ |
分析 锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为$\frac{26.88L}{22.4L/mol}$=1.2mol,剩余硫酸的物质的量为:n(H2SO4)剩=$\frac{1}{2}$×0.1L×1mol/L=0.05mol,
消耗硫酸的物质的量为:n(H2SO4)消耗=0.1L×18.5mol/L-0.05mol=1.8mol,根据反应的化学方程式计算.
解答 解:n(H2SO4)浓=0.1L×18.5mol/L=1.85mol,
剩余硫酸的物质的量为:n(H2SO4)剩=$\frac{1}{2}$×1L×0.1mol/L=0.05mol,
消耗硫酸的物质的量为:n(H2SO4)消耗=1.85mol-0.05mol=1.8mol,
锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,
生成气体为SO2和H2的混合物,物质的量为$\frac{26.88L}{22.4L/mol}$=1.2mol,
设混合物气体中含有xmolSO2,ymolH2,
Zn+2H2SO4=ZnSO4+SO2↑+H2O
2xmol xmol
Zn+H2SO4=ZnSO4+H2↑
ymol ymol
则有:x+y=1.2mol ①
2x+y=1.8mol ②
解得:x=0.6mol y=0.6mol
所以n(SO2):n(H2)=x:y=0.6:0.6=1:1
故选A.
点评 本题考查化学方程式的计算,题目难度中等,本题注意以下几点:①浓硫酸与锌反应生成SO2,②随着反应的进行,硫酸的浓度降低,与锌反应生成H2,③根据反应的方程式利用守恒的方法列式计算.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
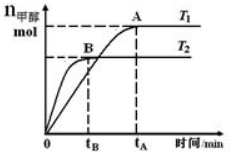 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )| A. | CO合成甲醇的反应为吸热反应 | |
| B. | 该反应在T1时的平衡常数比T2时的大 | |
| C. | 平衡常数K=$\frac{c(CO)•{c}^{2}({H}_{2})}{c(C{H}_{2}OH)}$ | |
| D. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸性溶液中:Na+、CO32-、NH4+、NO3- | |
| B. | 无色溶液中:Cl-、H+、Cu2+、SO42- | |
| C. | 使石蕊试液变蓝的溶液中:CO32-、Na+、MnO4-、K+ | |
| D. | 含SCN-的溶液中:K+、NH4+、Cl-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
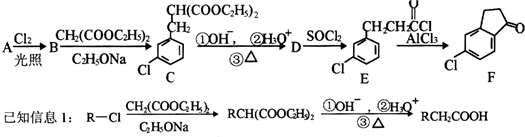
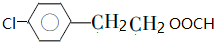 .
.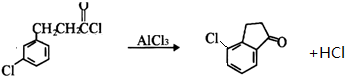 .
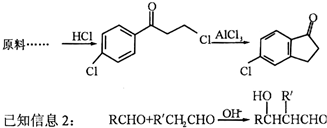
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com