
用下列装置进行相应实验,能达到实验目的的是
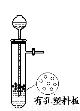
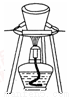
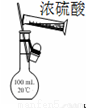

图1 图2 图3 图4
A.图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体
B.图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠
C.图3所示装置配制100 mL 0.1 mol·L-1的硫酸
D.图4所示装置用于分离出溴苯
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年河南省五岳八校高一下期末联考化学试卷(解析版) 题型:选择题
下列分子中所有原子都满足最外层为8电子结构的是( )
① BeCl ② NC13③ PCl5④ COC12⑤ SF6⑥ XeF2⑦ CS2 ⑧CH4⑨CF2C12⑩ S2C12
A. ②④⑦⑧⑧⑨⑩ B. ②④⑦⑨⑩ C. ③④⑦⑩ D. ③④⑤⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省唐山市高一下期末化学试卷(解析版) 题型:选择题
某原电池总反应的离子方程式是: Zn+Cu2+===Zn2++Cu,依据此反应设计原电池的正确组合是
选项 | 正极 | 负极 | 电解质溶液 |
A | Cu | Zn | 稀盐酸 |
B | C | Zn | 硫酸铜溶液 |
C | Zn | Cu | 氯化铜溶液 |
D | Zn | Cu | 硝酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省唐山市高二下期末化学试卷(解析版) 题型:填空题
运用所学知识,解决下列问题:
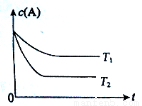
反应A(g)  B(g) +C(g)在容积为1.0 L的密闭容器中进行,A的初始浓度为0.050 mol/L。温度T1和T2下A的浓度与时间关系如图所示。
B(g) +C(g)在容积为1.0 L的密闭容器中进行,A的初始浓度为0.050 mol/L。温度T1和T2下A的浓度与时间关系如图所示。
回答下列问题:
(1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5 min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。(结果保留两位有效数字)
③反应在0~5 min区间的平均反应速率v(A)= 。
(3)合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ∆H= -92.2 kJ?mol-1
2NH3(g) ∆H= -92.2 kJ?mol-1
已知:
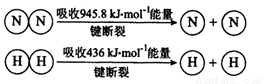
1mol N-H键断裂吸收的能量为 kJ。
(4)氨可用作碱性燃料电池的燃料,电池反应为 4NH3+3O2=2N2+6H2O,则氨燃料电池的负极电极反应为____。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省唐山市高二下期末化学试卷(解析版) 题型:选择题
常温下,向20 mL某浓度的盐酸中逐滴加入0.1 mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是
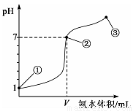
A.盐酸的物质的量浓度为l mol/L
B.在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
C.在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20
D.在点③所示溶液中:由水电离出的c(OH-)>l0-7mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省唐山市高二下期末化学试卷(解析版) 题型:选择题
化学与生活密切棚关。下列选项中原因与结论均正确的是
选项 | 原因 | 结论 |
A | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
B | 汽油和植物油都属于烃 | 汽油和植物油都可以用作车用燃料 |
C | 硅是良好的半导体材料 | 硅可用于制备光导纤维 |
D | 淀粉和蛋白质都是高分子化合物 | 淀粉和蛋白质都可水解生成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省宁德市高二下期末化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.C60气化和干冰升华克服的作用力相同
B.分子晶体在水溶液中一定能导电
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高二下期末化学试卷(解析版) 题型:填空题
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等。某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验。
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是 。
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用下图表示,此过程中与Pd起相同作用的物质为 (写名称)。
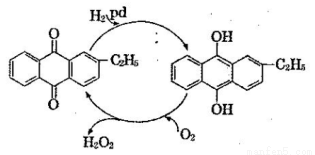
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
实验编号 | T/X | H202初始浓度/moL· L-1 | FeCl3初始浓度/ moL· L-1 moL· L-1L-1 |
I | 20 | 1.0 | |
II | 50 | 1.0 | 0 |
III | 50 | 0.1 |
①实验I、Ⅱ研究___________对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为 moL· L-1。
②三组实验中分解速率最慢的是 (填编号)。
III.过氧化氢含量的实验测定
兴趣小组同学用0.100 0 moL·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为 2MnO4- +5H2O2 +6H+ =2Mn2+ +8H2O+5O2↑
(4)滴定到达终点的现象是_ 。
(5)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4 标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为__________moL·L-1 (保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省宝鸡市岐山县高二下期末(有机)化学试卷(解析版) 题型:填空题
(1)请用下面的A-D字母填空:①乙酸乙酯制备 ;②乙醛的银镜反应 ;③石油分馏 ;④苯酚溶液与FeCl3溶液 :A.直接加热;B.垫石棉网加热;C.水浴加热;D.不需要加热。
(2)下列叙述正确的是 (填序号)
A.向碘水中加入酒精,萃取碘水中的碘
B.液化石油气、汽油和石蜡的主要成分都是碳氢化合物
C.用水解后的淀粉溶液做银镜反应,若有银镜产生,则证明淀粉部分水解
D.将无水乙醇和浓硫酸按体积比1∶3混合,加热至140℃制取乙烯
E.为证明溴乙烷分子中溴元素的存在,可向溴乙烷中加入NaOH溶液,加热;加入稀硝酸至溶液呈酸性,滴入AgNO3溶液看是否有淡黄色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com