

| A. | Zn片是正极 | B. | H+在铜片上得电子 | ||
| C. | 反应过程中电能转变为化学能 | D. | 电子从锌片通过硫酸溶液流向铜片 |
分析 Cu-Zn-稀硫酸原电池放电时,化学能转变为电能,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,据此分析.
解答 解:A、Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,负极上失电子发生氧化反应,故A错误;
B、较不活泼的金属铜作正极,正极H+在铜片上得电子发生还原反应,故B正确;
C、该原电池放电时,化学能转变为电能,故C错误;
D、电子从负极锌片沿导线流向正极铜片,不经过溶液,故D错误.
故选B.
点评 本题考查了原电池原理,难度不大,注意把握正负极的判断方法,难点是判断电子从负极锌片沿导线流向正极铜片,不经过溶液.


科目:高中化学 来源: 题型:选择题
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含质子数相等 | |
| C. | 标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等 | |
| D. | 12g C和16g O所含的原子数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的100gNa2O2与CO2反应后,固体质量变成了105.6g,此反应转移电子为0.4mol | |
| B. | 在Fe与含nmolHNO3的稀溶液反应中,被还原的HNO3不一定为$\frac{1}{4}$nmol | |
| C. | 在Mg与Al做电极,其它溶液做电解质构成原电池中,Mg一定为负极 | |
| D. | 碱性氧化物一定为金属氧化物,酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池一般比较小,即使埋到土壤中也不会造成太大危害 | |
| B. | 电池回收的主要目的是为了提取里面的银、汞等金属 | |
| C. | 废旧电池可以直接通过燃烧的方式销毁 | |
| D. | 电池不仅污染土壤,也污染地下水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 污染指数 | 首要污染物 | 空气质量级别 | 空气 质量状况 | ||
| 二氧化硫 | 二氧化氮 | 可吸入颗粒物 | |||
| 12 | 33 | 68 | 2 | 良 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
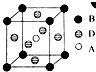 A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com