
NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 L 0.1 mol·L-1的NH4Cl溶液中NH4+数目为0.1NA
B.标准状况下,11.2 L SO2和SO3的混合物中硫原子数为0.5NA
C.通常情况下,3.4 g NH3中共用电子对数为0.8NA
D.6.4 g Cu在足量的硫蒸气中燃烧,转移的电子数为0.1NA
科目:高中化学 来源:2016-2017学年河南省南阳市宛东五校高二上第一次联考化学试卷(解析版) 题型:选择题
烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )

A.A为原电池,B为电解池
B.A中阳离子向碳极移动,阴离子向铁极移动
C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol
D.一段时间后,B烧杯中溶液的浓度增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热为ΔH=2×(-57.3) kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+(2×283.0) kJ·mol-1
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上学期9月月考化学试卷(解析版) 题型:选择题
亚硫酸及其盐在工业上具有广泛的用途。下面来解释亚硫酸及其盐的有关性质的方程式正确的是
A.亚硫酸水溶液的pH<7:H2SO3 2H++SO32-
2H++SO32-
B.将亚硫酸滴入饱和Na2CO3溶液有气泡产生:2H++CO32-=H2O+CO2↑
C.Na2SO3溶液能使红色石蕊变蓝:SO32-+H2O=HSO3-+OH-
D.Na2SO3溶液中加入足量的酸化Ba(NO3)2溶液出现白色沉淀:
3SO32-+2NO3-+2H++3Ba2+=3BaSO4↓+2NO↑+H2O
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上学期9月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.FeCl3溶液:NH4+、Mg2+、SO42-、NO3-
B.1.0mol/L的Na溶液:H+、Cu2+、I-、SO42-
C.c(H+)=0.001mol/L的溶液:Na+、K+、SiO32-、NO3-
D.能使含NH4+的溶液放出NH3的溶液:Na+、Mg2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次段考化学卷(解析版) 题型:实验题
四氯化锡用作媒染剂和有机合成的氯化催化剂,实验室制备四氯化锡的反应、装置示意图和有关信息如下:

有关信息:
①将金属锡熔融,通入干燥氯气进行反应,生成四氯化锡。
②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃。
⑧暴露于空气中与空气中的水分反应生成白烟,有强烈的刺激性,遇水分解。
回答下列问题:
(1)仪器C的名称是 。
(2)制备无水四氯化锡各装置的连接顺序是( )→( )→( )→( )→( )(填装置序号)。
(3)装置V的作用是 。
(4)若无装置V存在,在装置Ⅲ中除生成SnCl4外,还存在的副产物化学式为 。
(5)若Ⅱ中用去锡粉5.95 g,反应后,Ⅲ中锥形瓶里收集到12.0 g SnCl4,则SnCl4的产率为 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次段考化学卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A.向NaOH溶液中加入少量Mg(HCO3)2溶液:2OH-+Mg2+=Mg(OH)2↓
B.向足量NaHSO4溶液中逐滴加入Ba(HCO3)2溶液:HCO3-+Ba2++H++SO42-=BaSO4↓+H2O+CO2↑
C.酸性KMnO4溶液与H2O2反应:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O
D.向Fe(NO3)3溶液中加入过量HI溶液:Fe3++3NO3-+12H++10I-=Fe2++3NO↑+5I2+6H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5 kJ/mol、-285.8 kJ/mol、-890.3 kJ/mol。则CH4(g) == C(s) + 2H2(g)的反应焓变(△H)为( )
A.-74.8 kJ/mol B.+74.8 kJ/mol C.-211kJ/mol D.+211kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷(解析版) 题型:实验题
已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:
甲方案探究甲烷与氧化剂反应(如图1所示);
乙方案探究甲烷与氯气反应的条件(如图2所示)。
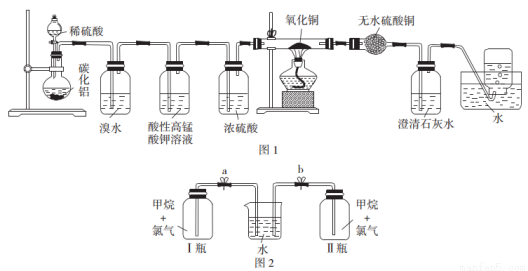
甲方案实验现象:溴水不褪色,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)的混合气体,I瓶放在光亮处,Ⅱ瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为____________________。
(2)实验甲中浓硫酸的作用是_______________,集气瓶中收集到的气体_________(填“能”或“不能”)直接排入空气中。
(3)下列对甲方案实验中的有关现象与结论的叙述都正确的是_________(填标号)。
A.酸性高锰酸钾溶液不褪色,结论是通常条件下甲烷不能与强氧化剂反应
B.硬质玻璃管里黑色粉末无颜色变化,结论是甲烷不与氧化铜反应
C.硬质玻璃管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(4)写出甲方案实验中硬质玻璃管里可能发生反应的化学方程式:________________(假设消耗甲烷与氧化铜的物质的量之比为2:7)。
(5)一段时间后,观察到图2装置中出现的实验现象是____________________;然后打开弹簧夹a、b,观察到的实验现象是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com