
【题目】下列物质中既含有非极性键,又含有离子键的是( )
A.MgBr2B.H2O2C.Na2O2D.NH4Cl
科目:高中化学 来源: 题型:
【题目】(1)0.3 mol NH3分子中所含原子数_____ ,质量是____,标准状况下的体积是____。
(2)含有0.4 mol Al3+的Al2(SO4)3溶液中所含SO42-的物质的量是______。
(3)等质量的SO2和SO3中, 硫原子个数之比为____,氧原子个数之比_______。
(4)配制100 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O质量为__________ ;0.5L0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。
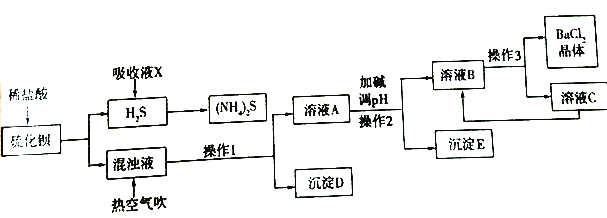
已知:室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]= 4.0×10-38
请回答下列问题:
(1)写出氯化钡的电子式________。盐酸和硫化钡反应的化学方程式为________。
(2)吸收液X的溶质是________。一定条件下向(NH4)2S溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为________。
(3)操作1的名称是________,操作3的过程是将容液B蒸发浓缩、________、过滤等。
(4)沉淀D的成分是________。
(5)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________。
(6)室温时,若加碱调溶液pH至9,则完全沉淀的离子是________ 。
(7)此工艺流程中循环利用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
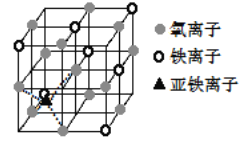
【题目】第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)在现代化学中,常利用______上的特征谱线来鉴定元素,称为光谱分析。
(2)写出 Cu2+的外围电子排布式__________;比较铁与锰的第三电离能(I3):铁____锰(填“>”、 “=”或“<”),原因是________________。
(3)已知 [Zn(CN)4]2-与甲醛在水溶液中发生反应可生成一种新物质 HOCH2CN,试判断新物质中碳原子的杂化方式___________;1mol[Zn(CN)4]2-中的 σ 键数为__________。
(4)如图是晶体 Fe3O4 的晶胞,该晶体是一种磁性材料, 能导电。
①晶胞中二价铁离子处于氧离子围成的______(填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为________。
③解释 Fe3O4 晶体能导电的原因_________________;若晶胞的体对角线长为 a nm,则 Fe3O4 晶体的密度为________g·cm-3(阿伏加德罗常数用 NA 表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是该有机物的质谱图,则其相对分子质量为________。
(2)分子式为C3H6O2的有机物,如果在核磁共振氢谱图上观察到氢的原子给出的峰有两种情况:第一种情况峰的强度比为1∶1,请写出其对应化合物的结构简式_____;第二种情况峰的强度比为3∶2∶1,请写出该化合物可能的结构简式__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法 反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度部分图象如图:
S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度部分图象如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法 ①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是___(填序号)。
a.c(Na+)+c(H+)>c(![]() )+c(
)+c(![]() )+c(OH)
)+c(OH)
b.水电离出c(H+)=1×108 mol/L
c.c(Na+)>c(![]() )>c(H+)>c(
)>c(H+)>c(![]() )
)
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加____mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式________,已知该反应在较低温条件下能自发进行,则该反应的△H ____0(填“>”“<”或“=”)。
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是________。
a. CO 的质量不再变化 b. 混合气体的密度不再变化
c.单位时间内生成 CO 和 NO 的物质的量相等 d. CO 和 CH3ONO 的浓度比不再变化
②10min 内该反应的速率 ν(NO)=____________;该温度下化学平衡常数 K=_________。若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________(填字母)。
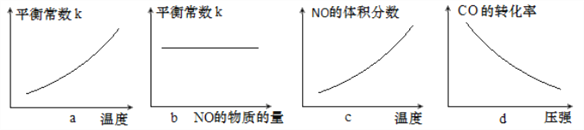
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com