
将铁、铜、氯化铁、氯化亚铁和氯化铜溶液置于某容器中,根据下述情况判断哪些阳离子
(不考虑阴离子)或金属单质还能在容器中存在(或不存在).(1)反应后铁有剩余,则容器中还可能有________.
(2)反应后容器中有相当多的Cu2+,则可能还有________.
(3)除Cu2+外,若还有Cu,则不可能有________.
(4)除Cu2+外,若还有相当多的Fe3+,则还可能有________.
|
答案: (1)Cu、Fe2+(2)Fe2+、Fe3+或Cu、Fe2+ (3)Fe3+和Fe (4)Fe2+ 讲析: (1)反应后Fe有剩余,能与Fe反应的是Cu2+和Fe3+,所以容器中可能存在的只有Cu、Fe2+.(2)反应后Cu2+有剩余,则容器中不可能存在单质Fe,同时要注意Cu和Fe3+也会反应而不能共存.(3)反应后剩余Cu2+和Cu,由于Cu2+和Fe能反应,Cu和Fe3+能反应,所以不可能有Fe3+和Fe.(4)反应后剩余Cu2+和Fe3+,由于Fe和Cu2+能反应,Fe3+和Cu或Fe都能反应,因此容器中可能有Fe2+存在.点评:此题运用“铁三角”相互转化的知识来解决问题.从题目所给的五种物质来看,实际考查的是 Fe、Fe2+、Fe3+、Cu、Cu2+五种微粒的共存问题.因此解决此题的思路是从题目所给的剩余离子出发,考虑其他微粒与其是否能够发生反应,如不反应则可存在;如能反应,一定要慎重考虑新生成的离子或物质能否存在,是否存在二次反应. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列反应中,相关示意图象错误的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀 | 3.9. | 9.7 | 6.4 | 8.0 |
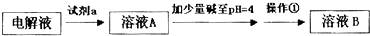
查看答案和解析>>
科目:高中化学 来源: 题型:
(2011?淄博二模)下列反应中,相关示意图象错误的是( )
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省长安一中高二下学期期中考试化学试卷(带解析) 题型:单选题
下列反应中,相关示意图图像错误的是( )
| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将氨水滴入到一定量氯化铝溶液中 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
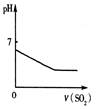 | 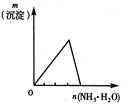 | 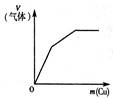 |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com