
amol���������ʷֱ���������ϡ���ᷴӦ�����軹ԭ����ֻ��һ�֣���������������ʵ������ɿ��������֣�һ����Ϊ�������������ᣬ��һ����Ϊ����ģ�������������ӵ���ʽ�����ڷ�Ӧ�����Һ��ά����Һ�ĵ����ԣ������и�ѡ������ȷ���ǣ���λ��mol���� ��
��Fe��3a+a �� ��Fe3O4��9a+ ��
��Fe��OH��2��3a+ �� ��FeSO4��a+
A���٢ڢۢ� B��ֻ�Т٢� C��ֻ�Тۢ� D��ֻ�Т٢ڢ�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ǹ�ҵ����Ҫ��ԭ�ϡ�
��1���������ڹ�ҵ�ϳɰ� N2(g) + 3H2(g) ![]() 2NH3(g)����H = -92.2 kJ��mol-1��
2NH3(g)����H = -92.2 kJ��mol-1��
һ���¶��£����ݻ��㶨���ܱ������У�һ������N2��H2��Ӧ�ﵽƽ��ı�ijһ�����������Ӧ������ʱ��Ĺ�ϵ����ͼ��ʾ������t4 �pt5 �pt7ʱ������Ӧ��ʵ�������ı�ֱ���
t4 t5 t7 ��
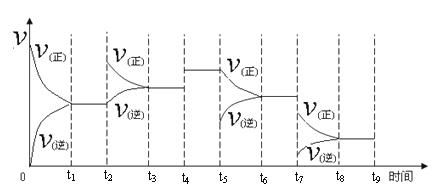
���¶�ΪT��ʱ����2amolH2��amolN2����0.5L�ܱ������У���ַ�Ӧ����N2��ת����Ϊ50������ʱ�ų�����46.1 kJ������¶��·�Ӧ��ƽ�ⳣ��Ϊ ��
��2����ҵ�ϴ�����������Դ�ڽ�̿��ˮ���������µķ�Ӧ��
C(s) + H2O(g) ![]() H2(g) + CO(g) ��H = +131.3 kJ/mol
H2(g) + CO(g) ��H = +131.3 kJ/mol
�ٸ÷�Ӧ�ڵ����²����Է����е�ԭ���� ��
�ں��£����ݻ��ɱ���ܱ������У��������Ͽ��淴Ӧ��һ��ʱ��������������������仯ʱ���ܱ����÷�Ӧ�Ѵﵽƽ��״̬���У�����������ܶȣ��������������ѹǿ����������������ʵ����� ��CO���ʵ���Ũ�� �� ��
A��ֻ�Т� B��ֻ�Т�͢� C��ֻ�Т�͢�
D����͢� E��������
��3�����ݻ���ͬ�����ܱ�����A��B�У������¶�Ϊ423K��ͬʱ��A��B�зֱ����amol��bmol�⻯�⣨a��b������Ӧ��2HI(g)![]() H2(g)+I2(g) �ﵽƽ���ƽ��ʱI2��Ũ��c(I2)A c(I2)B ��ƽ��ʱHI�ķֽ��ʦ�A ��B ��ƽ��ʱH2�ڻ�������е��������A B ����д��������������������
H2(g)+I2(g) �ﵽƽ���ƽ��ʱI2��Ũ��c(I2)A c(I2)B ��ƽ��ʱHI�ķֽ��ʦ�A ��B ��ƽ��ʱH2�ڻ�������е��������A B ����д��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��գ��д��ŵľ��ô��ű�ʾ��
��1�����и������ʣ�4�֣�
A���������ơ������ơ�����ͭ������þ
B������������������������
C�����ᡢ���ᡢ���ᡢ�����
D���������ơ������ơ�����ء�ʮ��ˮ��������
���ǵķ��������ǣ�A ��B ��
C ��D ��
��2�����и���Ʒ���豸��2�֣�
��ʯӢ�ӱ������մɲ;ߣ���ש�ߣ��ܹ�̫���ܵ�أ��ݹ��ά�������оƬ����ʯ�ޣ��ಣ��
�����ò���ΪSiO2 ���õ�SiO2���ǣ� ��
��Ϊ�����ε��ǣ�
��3���������������������ֳ�����������д�ڿհ״���4�֣�
��ʢ��Ũ������ձ����ڷ���һ��ʱ����������ӣ�Ũ�����
���������м���Ũ����ʱ�����DZ�ڣ�������ͣ�������ɶ�ĺ���״��̿�����д̼�����ζ���������Ũ�����
���ڳ����£�����������������ʢװ���Ũ���Ũ�����
����п������ϡ�����У�������ų���ϡ�����
��4����amol/L Cu S04��Һ��bmol/L H2S04��Һ�������ϣ����Ϻ����Ϊ���ǰ����Һ���֮�ͣ�������Һ��H+��SO42����Cu2+ �����ʵ���Ũ�ȷֱ���c(H+)= ; c(Cu2+)= ; c(SO42��)=
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�콭��ʡ�γ���ѧ������ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
�����ǹ�ҵ����Ҫ��ԭ�ϡ�
��1���������ڹ�ҵ�ϳɰ� N2(g) + 3H2(g) 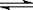 2NH3(g)����H =" -92.2" kJ��mol-1��
2NH3(g)����H =" -92.2" kJ��mol-1��
�� һ���¶��£����ݻ��㶨���ܱ������У�һ������N2��H2��Ӧ�ﵽƽ��ı�ijһ�����������Ӧ������ʱ��Ĺ�ϵ����ͼ��ʾ������t4 �pt5�pt7ʱ������Ӧ��ʵ�������ı�ֱ���
t4 t5 t7 ��
���¶�ΪT��ʱ����2amolH2��amolN2����0.5L�ܱ������У���ַ�Ӧ����N2��ת����Ϊ50������ʱ�ų�����46.1 kJ������¶��·�Ӧ��ƽ�ⳣ��Ϊ ��
��2����ҵ�ϴ�����������Դ�ڽ�̿��ˮ���������µķ�Ӧ��
C(s) + H2O(g) 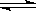 H2(g) + CO(g) ��H =" +131.3" kJ/mol
H2(g) + CO(g) ��H =" +131.3" kJ/mol
�ٸ÷�Ӧ�ڵ����²����Է����е�ԭ���� ��
�ں��£����ݻ��ɱ���ܱ������У��������Ͽ��淴Ӧ��һ��ʱ��������������������仯ʱ���ܱ����÷�Ӧ�Ѵﵽƽ��״̬���У�����������ܶȣ��������������ѹǿ����������������ʵ����� ��CO���ʵ���Ũ�� �� ��
A��ֻ�Т� B��ֻ�Т�͢� C��ֻ�Т�͢�
D����͢� E��������
��3�����ݻ���ͬ�����ܱ�����A��B�У������¶�Ϊ423K��ͬʱ��A��B�зֱ����amol��bmol�⻯�⣨a��b������Ӧ��2HI(g) H2(g)+I2(g) �ﵽƽ���ƽ��ʱI2��Ũ��c(I2)A c(I2)B ��ƽ��ʱHI�ķֽ��ʦ�A ��B ��ƽ��ʱH2�ڻ�������е��������A B ����д��������������������
H2(g)+I2(g) �ﵽƽ���ƽ��ʱI2��Ũ��c(I2)A c(I2)B ��ƽ��ʱHI�ķֽ��ʦ�A ��B ��ƽ��ʱH2�ڻ�������е��������A B ����д��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ������ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
�����ǹ�ҵ����Ҫ��ԭ�ϡ�
��1���������ڹ�ҵ�ϳɰ� N2(g)
+ 3H2(g)  2NH3(g)����H
= -92.2 kJ��mol-1��
2NH3(g)����H
= -92.2 kJ��mol-1��
�� һ���¶��£����ݻ��㶨���ܱ������У�һ������N2��H2��Ӧ�ﵽƽ��ı�ijһ�����������Ӧ������ʱ��Ĺ�ϵ����ͼ��ʾ������t4 �pt5 �pt7ʱ������Ӧ��ʵ�������ı�ֱ���
t4 t5 t7 ��
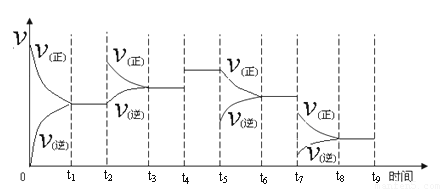
���¶�ΪT��ʱ����2amolH2��amolN2����0.5L�ܱ������У���ַ�Ӧ����N2��ת����Ϊ50������ʱ�ų�����46.1 kJ������¶��·�Ӧ��ƽ�ⳣ��Ϊ ��
��2����ҵ�ϴ�����������Դ�ڽ�̿��ˮ���������µķ�Ӧ��
C(s) + H2O(g)  H2(g)
+ CO(g) ��H = +131.3 kJ/mol
H2(g)
+ CO(g) ��H = +131.3 kJ/mol
�ٸ÷�Ӧ�ڵ����²����Է����е�ԭ���� ��
�ں��£����ݻ��ɱ���ܱ������У��������Ͽ��淴Ӧ��һ��ʱ��������������������仯ʱ���ܱ����÷�Ӧ�Ѵﵽƽ��״̬���У�����������ܶȣ��������������ѹǿ����������������ʵ����� ��CO���ʵ���Ũ�� �� ��
A��ֻ�Т� B��ֻ�Т�͢� C��ֻ�Т�͢�
D����͢� E��������
��3�����ݻ���ͬ�����ܱ�����A��B�У������¶�Ϊ423K��ͬʱ��A��B�зֱ����amol��bmol�⻯�⣨a��b������Ӧ��2HI(g)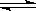 H2(g)+I2(g) �ﵽƽ���ƽ��ʱI2��Ũ��c(I2)A
c(I2)B ��ƽ��ʱHI�ķֽ��ʦ�A ��B
��ƽ��ʱH2�ڻ�������е��������A B ����д��������������������
H2(g)+I2(g) �ﵽƽ���ƽ��ʱI2��Ũ��c(I2)A
c(I2)B ��ƽ��ʱHI�ķֽ��ʦ�A ��B
��ƽ��ʱH2�ڻ�������е��������A B ����д��������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com