
【题目】海带具有从海水中富集碘的能力,下面是从海带中提取碘单质的流程:
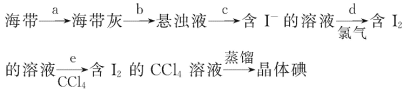
(1)步骤c的操作方法是__________;除漏斗、烧杯外,还需要使用的玻璃仪器是_________。
(2)步骤d所得溶液的颜色为_______,反应的离子方程式为_______________________________。
(3)步骤e中加入CCl4振荡、静置后,液体分为两层,上层液体呈_____色,下层液体呈______色;步骤e的操作方法是_____________,所用的主要实验仪器是___________________________。
【答案】过滤 玻璃棒 黄褐色 Cl2+2I=2Cl+I2 无 紫红 萃取 分液漏斗
【解析】
由提取海带中的碘的实验流程可知,海带在坩埚中灼烧,b为加入水溶解得到悬浊液,步骤c为过滤,得到含碘离子的溶液,d中通入氯气氧化碘离子得到含碘单质的溶液,然后加入四氯化碳萃取分液,得到含碘单质的四氯化碳溶液,通过蒸馏提纯得到碘单质,以此来解答。
(1)步骤c的操作是过滤,用于分离固体和溶液,该操作中涉及到的玻璃仪器有漏斗、烧杯和玻璃棒,故答案为:过滤;玻璃棒;
(2)步骤d中发生反应是氯气氧化碘离子生成碘单质,溶液的颜色为黄褐色,发生的离子方程式为:Cl2+2I=2Cl+I2,故答案为:黄褐色;Cl2+2I=2Cl+I2;
(3) 步骤e的操作加入四氯化碳萃取分液,用到分液漏斗,四氯化碳比水重在溶液下层,操作时在含I2的溶液中加入CCl4,振荡、静置后,液体分为两层,上层液体接近无色,下层液体呈紫红色,故答案为:无;紫红;萃取;分液漏斗。


科目:高中化学 来源: 题型:
【题目】氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为______。氧元素与氟元素能形成OF2分子,该分子的空间构型为______
(2)根据等电子体原理,在NO2+中氮原子轨道杂化类型是______;1molO22+中含有的π键数目为______个
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr基态核外电子排布式为______
(4)下列物质的分子与O3分子的结构最相似的是______
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+l)。下列有关元素X的说法中,不正确的是()
A. 元素X的原子核内质子数可能为(2a2-l)
B. 元素X形成的单质既能作氧化剂又能作还原剂
C. 元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
D. 由元素X形成的某些化合物,可能具有杀菌消毒的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 溶液与
溶液与![]() 溶液发生反应:
溶液发生反应:![]() ,达到平衡。下列说法不正确的是( )
,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯2次萃取分离后,在水溶液中加入![]() ,溶液呈血红色,表明该化学反应存在限度
,溶液呈血红色,表明该化学反应存在限度
C. 加入![]() 固体,平衡逆向移动
固体,平衡逆向移动
D. 该反应的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄色固体X,可能含有漂白粉、![]() 、
、![]() 、
、![]() 、
、![]() 之中的几种或全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是( )
之中的几种或全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是( )
A. X中含![]() ,可能含有
,可能含有![]()
B. X中含有漂白粉和![]()
C. X中含有![]() ,Y中含有
,Y中含有![]()
D. 用![]() 酸化溶液Z,若有黄绿色气体放出,说明X中含有
酸化溶液Z,若有黄绿色气体放出,说明X中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_______
a.反应速率![]() ( NH3) =
( NH3) =![]() ( N2)
( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是![]() (正)____
(正)____![]() (逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是
(逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是![]() (正)____
(正)____![]() (逆)(填﹥、﹤或﹦)。
(逆)(填﹥、﹤或﹦)。

(2)298 K时,若已知生成标准状况下2.24 L NH3时放出热量为4.62 kJ。写出合成氨反应的热化学方程式_______。在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4 kJ,其原因是________。
(3)一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |