
(8��)�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2O(g)Ϊԭ�ϣ�ͨ����ӦI��II���Ʊ��״���
��ش��������⣺
(1)��1.0molCH4��2.0molH2O(g)ͨ�뷴Ӧ��(�ݻ�Ϊl00L)����һ�������·�����Ӧ��
cCH4(g)+H2O(g) 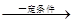 CO(g)+3H2(g)
I��
CO(g)+3H2(g)
I��
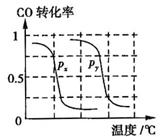
CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
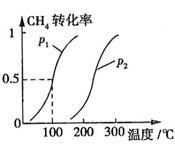
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ
��ͼ�е�P1 P2(�<������>����=��)��100��ʱƽ�ⳣ��Ϊ ��
�۸÷�Ӧ��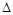 H
0��(�<������>����=��)
H
0��(�<������>����=��)
(2)��ѹǿΪ0.1MPa�����£�a molCO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO(g)+2H2(g) CH30H(g)
CH30H(g) 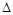 H<0 ��
H<0 ��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� (�����)��
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���lmolCO��3 mol H2
��Ϊ��Ѱ�Һϳɼ״��������¶Ⱥ�ѹǿ��ijͬѧ���������ʵ�飬����ʵ�������Ѿ������������ʵ����Ʊ��С�
|
ʵ���� |
T(��) |
n(CO)��n(H2) |
p(MPa) |
|
l |
150 |
1��3 |
0.1 |
|
2 |
n |
1��3 |
5 |
|
3 |
350 |
m |
5 |
a���ϱ���ʣ���ʵ���������ݣ�n= ��m= ��
b�����ݷ�Ӧ����ص㣬��ͼ����ѹǿ�ֱ�Ϊ0.1MPa��5MPa��CO��ת�������¶ȱ仯������ͼ����ָ��ͼ�е�ѹǿ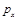 = MPa��
= MPa��
��1����0.0030mol/L ��< , 2.25��10-4 ��>
(2)��B D ��150
1/3 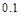
��������
���������
��1���ٸ������ʼ��㹫ʽV=3mol��(5*60*100)= 0.0030mol/��L.s)
������ͬ�¶��£�P1��CH4ת���ʱ�P2�ĸߣ�������ԭƽ����˵ѹǿ��С�������ƶ�������P1С��
P2 , ��ѧƽ�ⳣ��K=�������Ũ����֮��/��Ӧ���Ũ����֮������������2.25��10-4
����ͼ��֪���¶ȸ�ʱ��CH4ת���ʸߣ������ƶ�������������Ϊ���ȷ�Ӧ��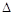 HС��0��
H��0��
��2���ټ�С������Ũ�ȣ�������Ӧ��Ũ�ȶ�����������ת���ʣ��������¶�ֻ�������˷�Ӧ���ʣ�����He����Ӱ�췴Ӧ���ʡ�
�� �Ա����飬1��2�Աȣ�����n=150��2��3���ڣ�����m=1/3 ;����ԭƽ�⣬����ѹǿ�����ƶ�������Py��Px������Px=0.1MPa ��
���㣺��ѧ��Ӧƽ��ԭ������ͼ�������
�����������ϳ��滯ѧƽ�����¶ȡ�ѹǿͼ���з�������Ϣ���ϴ���Ŀ�Ѷ��еȡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ����ʦ���С��ٴ�һ�и���12��������ѧ�Ծ����������� ���ͣ������
(8��)�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2O(g)Ϊԭ�ϣ�ͨ����ӦI��II���Ʊ��״���
��ش��������⣺
(1)��1.0molCH4��2.0molH2O(g)ͨ�뷴Ӧ��(�ݻ�Ϊl00L)����һ�������·�����Ӧ��
cCH4(g)+H2O(g)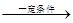 CO(g)+3H2(g) I��
CO(g)+3H2(g) I��
CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��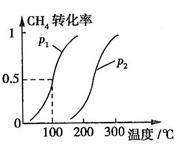
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ
��ͼ�е�P1 P2(�<������>����=��)��100��ʱƽ�ⳣ��Ϊ ��
�۸÷�Ӧ�� H 0��(�<������>����=��)
H 0��(�<������>����=��)
(2)��ѹǿΪ0.1MPa�����£�a molCO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO(g)+2H2(g) CH30H(g)
CH30H(g)  H<0 ��
H<0 ��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� (�����)��
| A�������¶� | B����CH3OH(g)����ϵ�з��� |
| C������He��ʹ��ϵ��ѹǿ���� | D���ٳ���lmolCO��3 mol H2 |
| ʵ���� | T(��) | n(CO)��n(H2) | p(MPa) |
| l | 150 | 1��3 | 0.1 |
| 2 | n | 1��3 | 5 |
| 3 | 350 | m | 5 |
 = MPa��
= MPa��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com